Cosa succede ora col vaccino contro il coronavirus
Dopo l'annuncio di lunedì di Pfizer: quali sono i tempi, che cos'è un'autorizzazione di emergenza e chi sta prenotando milioni di dosi
di Emanuele Menietti – @emenietti

Lunedì 9 novembre l’azienda farmaceutica statunitense Pfizer ha annunciato che il suo vaccino sperimentale contro il coronavirus, sviluppato dalla tedesca BioNTech, si è rivelato molto più efficace del previsto nell’ultima fase (su 3) di test su esseri umani, ancora in corso e da completare. La notizia è stata accolta con interesse dai ricercatori, ha portato a grande ottimismo tra gli investitori in Borsa e ha spinto istituzioni sanitarie e governi ad annunciare nuove prenotazioni per l’acquisto di milioni di dosi del vaccino.
La notizia sui progressi e i risultati raggiunti è sicuramente positiva, ma i tempi per avere un vaccino saranno ancora relativamente lunghi e saranno legati alle procedure di autorizzazione da parte delle autorità sanitarie, alla capacità di Pfizer di produrre materialmente i vaccini e al tempismo dei governi nell’acquistarli e distribuirli. Oltre a Pfizer, diverse altre aziende stanno sviluppando vaccini contro il coronavirus, impiegando tecniche diverse e che dovrebbero portare a qualche risultato da qui alla prossima primavera.
Che cosa fa il vaccino di Pfizer/BioNTech
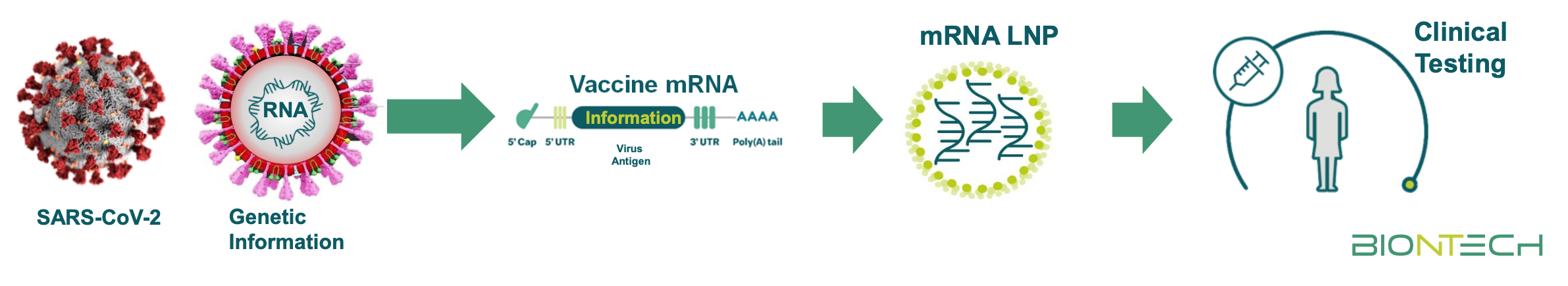
Da diversi anni, BioNTech si è specializzata nella ricerca di soluzioni basate sull’RNA messaggero (mRNA), la molecola che si occupa di codificare e portare le istruzioni contenute nel DNA per produrre le proteine. L’azienda realizza forme sintetiche di mRNA – quindi create in laboratorio – che contengono istruzioni per far produrre all’organismo specifiche proteine, che il sistema immunitario impara poi a riconoscere e a contrastare. Queste proteine possono essere tipiche di alcune cellule tumorali, per esempio, oppure di agenti esterni come batteri e virus.
A inizio anno, i ricercatori di BioNTech si sono messi al lavoro per sviluppare un vaccino contro il coronavirus a base di mRNA. Semplificando molto: nel vaccino sono contenute le istruzioni per indurre il nostro organismo a creare una particolare proteina del coronavirus, che viene poi riconosciuta come estranea dal sistema immunitario e contrastata. In questo modo, il sistema immunitario impara a contrastare un elemento chiave del coronavirus, ma senza i rischi legati alla presenza del virus nella sua interezza.
Nel caso di un contagio dopo la vaccinazione, quelle conoscenze acquisite possono essere impiegate dal sistema immunitario per contrastare il coronavirus, sbarrandogli la strada e impedendogli di legarsi alle cellule per replicarsi e portare avanti l’infezione virale.
Sperimentazione e test
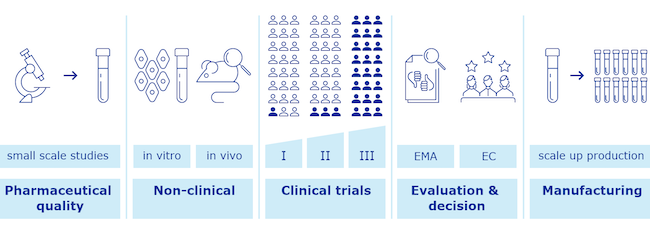
Lo sviluppo di un nuovo vaccino richiede di solito molto tempo e il dispendio di grandi energie. L’urgenza di averne uno a disposizione per contrastare l’attuale pandemia ha però portato a un’accelerazione senza precedenti, con diverse aziende farmaceutiche e centri di ricerca che hanno realizzato in brevissimo tempo i loro vaccini sperimentali. Lo sviluppo è solo la fase iniziale di un processo di controllo e verifica molto più lungo e articolato.
Un nuovo vaccino viene prima di tutto sottoposto a numerosi test e analisi di laboratorio, per verificarne qualità e caratteristiche. Superati questi primi controlli, i ricercatori avviano i test non clinici, quindi da eseguire in laboratorio in vitro su campioni di cellule e su cavie. È un primo passaggio molto delicato e utile per assicurarsi non solo che il vaccino faccia ciò per cui è stato programmato, ma anche che sia sicuro e non comporti particolari effetti avversi.
Raggiunti gli standard di sicurezza, si procede con i test clinici, cioè con le sperimentazioni svolte su esseri umani. I test sono solitamente suddivisi in tre fasi: nella prima si valuta su un numero molto ridotto di volontari la sicurezza del vaccino; nella seconda si fanno le medesime valutazioni, ma su un numero più alto di individui e raccogliendo già alcune informazioni sull’efficacia del vaccino; infine nella terza fase si effettua una sperimentazione su decine di migliaia di volontari per appurare che il vaccino sia efficace, oltre che sicuro.
(Agenzia europea per i medicinali)
I test di Pfizer
Dopo avere sperimentato alcune varianti del vaccino per identificare il più promettente, lo scorso luglio BioNTech e Pfizer hanno avviato la fase 3 dei test clinici per il loro vaccino sperimentale contro il coronavirus. Nei mesi seguenti hanno raggiunto la quota di circa 44mila volontari, divisi in due gruppi: il primo ha ricevuto il vaccino, mentre il secondo una sostanza che non fa nulla (placebo). I ricercatori hanno poi atteso di vedere in quanti si ammalassero per valutare la capacità del vaccino di offrire una protezione di qualche tipo.
Stando alle informazioni fornite lunedì da Pfizer, 94 partecipanti su 44mila si sono ammalati di COVID-19. Una commissione indipendente si è poi occupata di verificare quanti di questi malati avessero ricevuto il vaccino e quanti il placebo. Dalle loro verifiche è emerso che il vaccino ha un livello di efficacia intorno al 90 per cento, molto superiore alle aspettative. Al momento solo la commissione indipendente è a conoscenza del numero esatto di individui nei due gruppi, ma considerato il dato percentuale possiamo dedurre che un numero molto ristretto di volontari vaccinati si sia finora ammalato di COVID-19.
Buono?
La parola “finora” è la chiave per valutare l’esito, perché il test clinico è ancora in corso e si stanno quindi raccogliendo ulteriori dati sui pazienti. Se la percentuale di efficacia dovesse confermarsi intorno a quel valore sarebbe un risultato molto importante e positivo.
Per avere un metro di confronto, per quanto parziale, basta pensare ai vaccini di cui disponiamo da tempo. Quello contro l’influenza stagionale ha un livello di efficacia tra il 40 e il 60 per cento, a seconda degli anni e della capacità di prevedere correttamente quali saranno i ceppi influenzali che circoleranno di più tra la popolazione in una data stagione influenzale. Tra i vaccini con il livello di efficacia più alto c’è quello contro il morbillo, che dopo il ricevimento della seconda dose si attesta intorno al 97 per cento (da decenni contribuisce a salvare milioni di vite).
Soglia di efficacia
Le principali autorità sanitarie hanno fissato un limite minimo di efficacia per i vaccini sperimentali contro il coronavirus. La Food and Drug Administration (FDA), l’agenzia federale che si occupa di farmaci negli Stati Uniti, ha per esempio stabilito che un vaccino debba dimostrarsi nei test clinici efficace almeno al 50 per cento. Solo al di sopra di questa soglia le aziende farmaceutiche possono chiedere l’avvio di una procedura per l’autorizzazione di emergenza all’uso del vaccino.
Autorizzazione di emergenza
In particolari circostanze, la FDA prevede che farmaci e vaccini possano essere distribuiti alla popolazione accelerando i processi di verifica. Questa procedura (Emergency Use Authorization, EUA) non implica naturalmente che siano trascurati gli aspetti di sicurezza legati al vaccino, e prevede controlli anche nella fase di diffusione dei primi milioni di dosi.
Pfizer ha anticipato di volere procedere con una EUA entro la fine della terza settimana di novembre, dopo che avrà raccolto dati per due mesi su tutti i volontari, come richiesto dalla FDA per potere accedere alla richiesta di autorizzazione di emergenza.
Ottenuto il materiale, la FDA affiderà a una commissione esterna di esperti l’analisi dei dati, che potrebbe richiedere diverse settimane per essere completata. Non sarà solamente valutata l’efficacia del vaccino sperimentale, ma anche la sicurezza e la capacità dell’azienda di produrre milioni di dosi mantenendo gli standard richiesti dai regolamenti.

Quando sarà autorizzato?
È ancora difficile fare stime certe sull’autorizzazione del vaccino di Pfizer. Se tutto dovesse procedere senza imprevisti (e in queste procedure ce ne sono spesso), la FDA potrebbe dare la propria autorizzazione entro la fine dell’anno per l’impiego del vaccino sulla popolazione ad alto rischio.
Tempi
I primi a ricevere il vaccino negli Stati Uniti potrebbero essere medici, infermieri e il resto del personale sanitario entro la fine di gennaio 2021. Il resto della popolazione potrà iniziare a ricevere il vaccino entro la primavera, ma molto dipenderà dalla capacità di Pfizer di produrre decine di milioni di dosi ogni mese, dalla loro disponibilità nei vari stati e dai risultati a distanza di qualche mese dalle prime somministrazioni.
La FDA terrà infatti sotto controllo i primi vaccinati, per assicurarsi che non emergano effetti avversi non rilevati durante i test clinici, o elementi che portino a rivedere le stime sull’efficacia del vaccino. Pfizer proseguirà intanto con la fase 3 del suo test clinico fino al raggiungimento di 164 casi di COVID-19 tra i circa 44mila volontari arruolati. I risultati completi saranno poi esaminati per confermare o smentire i dati preliminari annunciati a inizio settimana dall’azienda.
Funzionerà davvero?
Per sapere quanto sia davvero efficace il vaccino sarà comunque necessario attendere dati reali su milioni di individui vaccinati. Valutando i risultati ottenuti finora e usando un po’ di statistica, diversi esperti dicono di essere comunque ottimisti sulla possibilità che il livello di efficacia sia molto alto.
È bene ricordare che le informazioni fornite a inizio settimana da Pfizer non sono dettagliate. Non è chiaro se il vaccino contribuisca a prevenire i casi più gravi di COVID-19, quindi riducendo la letalità della malattia, i ricoveri e di conseguenza il carico di lavoro per i sistemi sanitari. Non sono inoltre noti gli effetti del vaccino per fascia di età, dettaglio importante considerato che le persone più anziane tendono a essere maggiormente a rischio di sviluppare sintomi gravi, talvolta letali. Infine, non sappiamo per quanto tempo il vaccino offra una protezione contro il coronavirus, e se sia quindi necessario sottoporsi periodicamente a nuove somministrazioni.
Difficoltà
Anche realizzare e distribuire il vaccino non sarà semplice. Pfizer ha annunciato che potrebbe produrre circa 50 milioni di dosi entro la fine dell’anno, mentre nel 2021 potrebbe raggiungere una produzione di 1,3 miliardi di vaccini. La società ha avviato da qualche tempo la produzione, in modo da avere in magazzino dosi immediatamente disponibili nel caso di un’autorizzazione d’emergenza.
Il problema è che il vaccino di Pfizer deve essere conservato a una temperatura intorno ai -70 °C per mantenere inalterate le sue caratteristiche e va somministrato con due iniezioni, la seconda a distanza di tre settimane dalla prima. Garantire la catena del freddo sarà una delle principali sfide per l’azienda e per le società di trasporto che si occuperanno di distribuire le dosi, in giro per il mondo. Pfizer ha annunciato di avere sviluppato scatole con materiale isolante e ghiaccio secco, che dovrebbero garantire il mantenimento a -70 °C per diversi giorni.

(AP Photo/Carolyn Kaster)
Ospedali e cliniche che vorranno utilizzare questo vaccino dovranno quindi dotarsi di congelatori adeguati, e piuttosto costosi. Questo potrebbe limitare la disponibilità del vaccino di Pfizer, rendendolo per lo più disponibile nei grandi ospedali e nelle grandi aree urbane, rispetto alle aree rurali che richiederebbero tempi di consegna più lunghi e maggiori difficoltà nel mantenimento della catena del freddo.
Avviato lo scongelamento, il vaccino deve essere impiegato entro cinque giorni. Si potrebbero quindi pensare iniziative per vaccinare in breve tempo centinaia di persone in aree sprovviste dei congelatori adeguati, seppure con il rischio di qualche spreco nel caso in cui non fossero utilizzate tutte le dosi. Salvo cambiamenti, Pfizer prevede infatti di effettuare consegne con lotti minimi da 975 dosi.
Concorrenti
Pfizer e BioNTech sono solamente due delle molte aziende farmaceutiche e dei numerosi centri di ricerca al lavoro per sviluppare un vaccino contro il coronavirus. Diverse di queste società hanno avviato da qualche mese la loro fase 3 di test, quindi su larga scala e con migliaia di volontari.
Tra i vaccini sperimentali concorrenti più promettenti ci sono quello della statunitense Moderna – che si basa su un principio simile a quello di Pfizer, quello della cinese CanSino Biologics, quello della statunitense Johnson & Johnson e il vaccino di AstraZeneca, sviluppato nel Regno Unito tramite una collaborazione con l’Università di Oxford. Anche queste aziende stanno lavorando per raccogliere dati a sufficienza per procedere con una richiesta di autorizzazione di emergenza. Entro la prossima primavera potrebbero quindi esserci diversi vaccini tra cui scegliere, con disponibilità per la maggior parte dei paesi che ne faranno domanda.
Economia
Di solito le aziende farmaceutiche e i centri di ricerca sviluppano un vaccino sapendo che poi questo avrà mercato, grazie alla domanda dei governi. Prima ancora che il vaccino sia pronto, i paesi si attivano per effettuare i loro ordini, impegnandosi a spendere centinaia di milioni di euro, se non miliardi, per avere le dosi non appena sia pronta l’autorizzazione da parte delle autorità di controllo sui farmaci.
Per esempio: Pfizer lo scorso luglio ha ricevuto dal governo degli Stati Uniti un ordine da 1,95 miliardi di dollari per circa 100 milioni di dosi. L’accordo è un classico acquisto anticipato, il cui pagamento viene onorato solo nel caso in cui Pfizer sia in grado di distribuire un vaccino funzionante. La società ha investito proprie risorse per lo sviluppo e la produzione, senza accettare fondi governativi dagli Stati Uniti, come hanno invece fatto Moderna e AstraZeneca, nell’ambito del progetto “Operation Warp Speed” per accelerare la ricerca di un vaccino contro il coronavirus.
E in Europa?
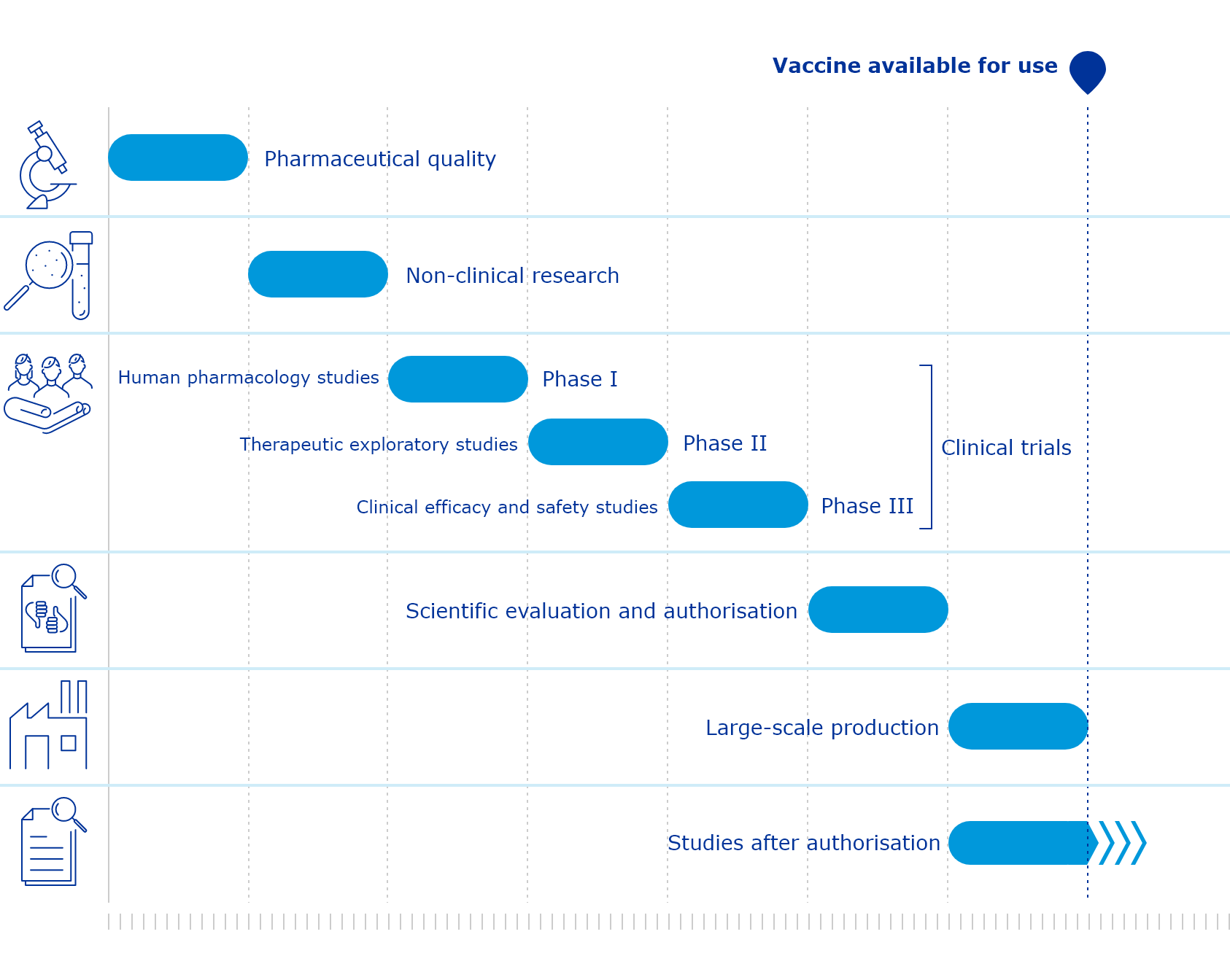
Il processo di verifica e autorizzazione dei vaccini nell’Unione Europea spetta all’Agenzia europea per i medicinali (EMA), che ha in parte funzioni paragonabili a quelle della FDA statunitense, e infine alla Commissione Europea. L’EMA ha previsto un percorso di verifica accelerato per i vaccini contro il coronavirus, offrendo assistenza ad aziende e centri di ricerca sul modo più adeguato per raccogliere i dati preliminari sui loro test clinici, che dovranno poi essere esaminati dagli esperti nominati dall’EMA.
Solitamente un vaccino diventa disponibile per un impiego generalizzato quando supera i test, le autorizzazioni e raccoglie un volume significativo di studi scientifici sulle sue caratteristiche.
(Agenzia europea per i medicinali)
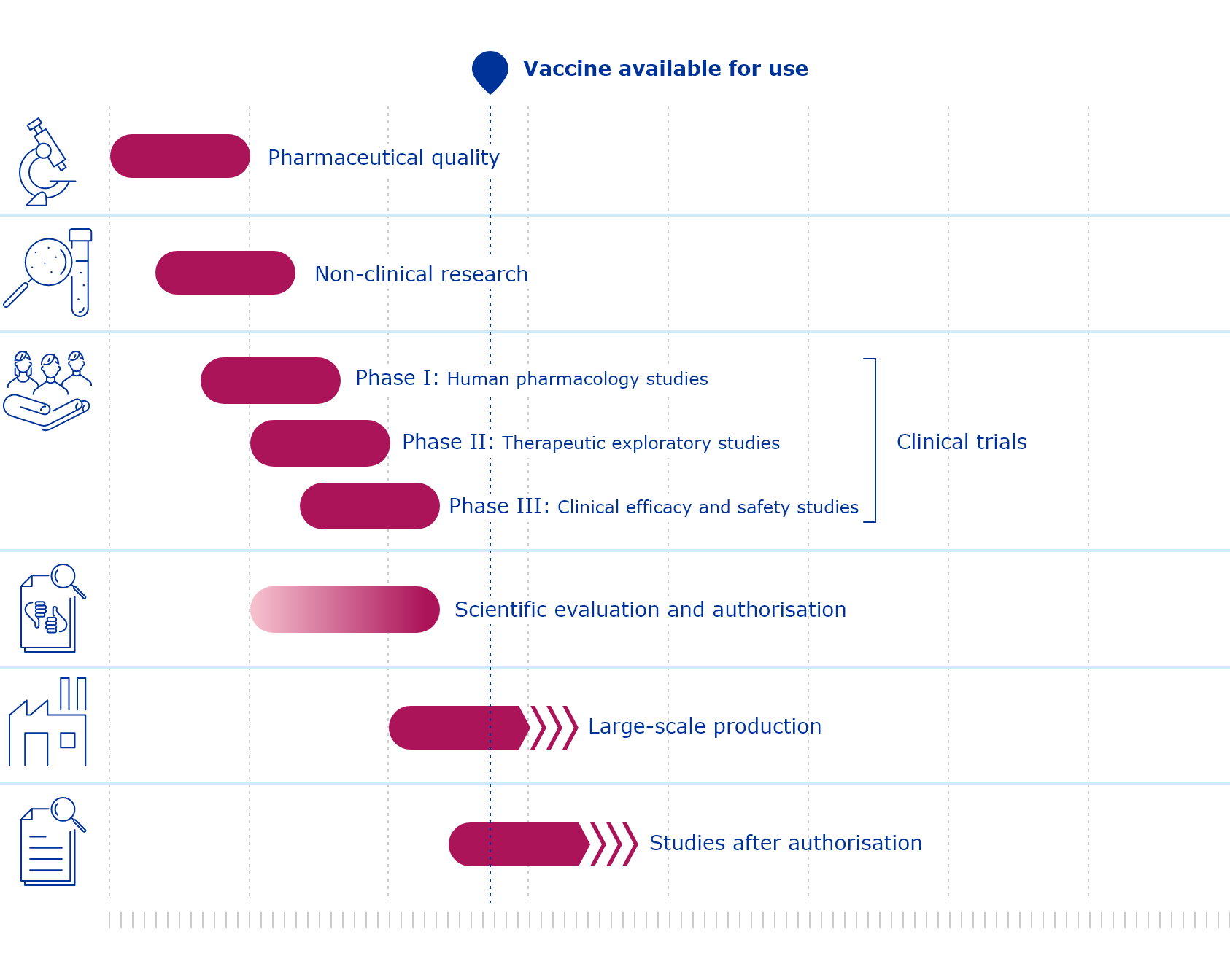
Nel caso dei vaccini contro il coronavirus, l’EMA prevede di accelerare i tempi, anticipando il passaggio in cui il vaccino diventa disponibile. L’obiettivo è di arrivarci ancora prima della conclusione della fase 3 dei test clinici, proprio come negli Stati Uniti con l’autorizzazione di emergenza.
(Agenzia europea per i medicinali)
Questo approccio non implica naturalmente che i vaccini siano sottoposti a minori controlli: devono comunque rispettare gli standard di sicurezza ed efficacia imposti dalle normative europee. L’EMA ha inoltre previsto l’impiego di più risorse e personale per l’analisi dei dati derivanti dai test clinici.
Nei mesi scorsi, la Commissione Europea ha stretto accordi con i produttori dei vaccini ritenuti più promettenti, prenotando:
• 300 milioni di dosi del vaccino di AstraZeneca;
• 300 milioni di dosi per il vaccino di Sanofi-GSK;
• 200 milioni di dosi per il vaccino di Johnson & Johnson.
La Commissione ha inoltre annunciato di avere avviato la procedura per prenotare circa 300 milioni di dosi del vaccino di Pfizer e BioNTech, per estendere ulteriormente le opzioni a disposizione dell’Unione Europea nei prossimi mesi della pandemia.
E l’Italia?
Il governo italiano si sta organizzando per la gestione degli ordinativi, anche se i piani non sono ancora completamente chiari. L’Italia avrà accesso al 13,5 per cento circa dei 300 milioni di dosi che l’Unione Europea dovrebbe ottenere da Pfizer, quindi più di 40 milioni di dosi. La loro ripartizione viene calcolata sulla base della popolazione di ciascuno stato e di altri parametri legati alla diffusione della pandemia.



