Il premio Nobel per la Chimica per la microscopia crioelettronica
Jacques Dubochet, Joachim Frank e Richard Henderson sono stati premiati per avere sviluppato i sistemi che ci permettono di osservare le molecole della vita

Il premio Nobel per la Chimica 2017 è stato assegnato a Jacques Dubochet, Joachim Frank e Richard Henderson per i loro studi che hanno “sviluppato la microscopia crioelettronica per determinare in alta definizione le strutture delle biomolecole”. La microsopia crioelettronica consente di ottenere immagini molto chiare e nitide di aggregati molecolari come le proteine, e permette di analizzare con maggiore precisione le relazioni spaziali tra le molecole in modo più semplice e immediato rispetto ad altri metodi come la cristallografia. L’impiego della microscopia crioelettronica negli ultimi anni ha permesso di accelerare la ricerca, soprattutto nello studio di nuovi principi attivi e farmaci. Dubochet, Frank ed Henderson hanno sviluppato un metodo per creare immagini tridimensionali delle biomolecole, riuscendo a renderle visibili chiaramente a una risoluzione atomica, portando la biochimica “in una nuova era”, secondo il comitato dei Nobel.
Dalla cristallografia al microscopio elettronico
Per molti decenni, le biomolecole (proteine, DNA e RNA) sono state sostanzialmente inesplorabili: gli scienziati erano consapevoli della loro importanza nelle cellule, ma non avevano idea di come fossero organizzate nello spazio e che forma avessero. Nei primi anni Cinquanta, le prime tecniche di esposizione di cristalli di proteine ai raggi-X (cristallografia) resero possibile l’osservazione delle strutture delle biomolecole, per quanto con un grande livello di approssimazione. Le cose migliorarono negli anni Ottanta, quando altre tecniche come la spettroscopia con tecnica di risonanza magnetica (MRS) consentirono di condurre studi più accurati sulle proteine al loro stato solido e/o immerse in soluzione. Il sistema consentiva inoltre di osservare il modo in cui si muovono le molecole e interagiscono tra loro.
Cristallografia e MRS sono state per anni al centro della ricerca biomolecolare e hanno permesso di creare sterminati archivi di immagini, studi e modelli delle molecole. Il problema è che questi due sistemi hanno evidenti limitazioni, per esempio non consentono di osservare molecole troppo complesse o male organizzate spazialmente. In un certo senso, le immagini ottenute con questi metodi possono essere paragonate a quelle delle prime macchine fotografiche: danno l’idea del soggetto, ma la loro definizione è molto bassa.
I primi modelli 3D di una proteina
Richard Henderson iniziò a lavorare con la cristallografia mentre era dottorando presso l’Università di Cambridge, nel Regno Unito, alla fine degli anni Sessanta. La utilizzava per studiare le proteine, ma si rese presto conto che non era una tecnica adatta per quelle che si trovano all’interno della membrana cellulare. Se vengono rimosse dal loro ambiente naturale (la membrana), queste proteine si raggomitolano e diventa impossibile comprenderne la struttura. Dopo anni di risultati deludenti, Henderson pensò di provare una strada alternativa e di usare il microscopio elettronico, che a differenza di un normale microscopio non usa la luce, ma un fascio di elettroni che colpiscono il campione da osservare. Rispetto alla luce, la lunghezza d’onda degli elettroni è molto più corta, quindi il microscopio può mostrare strutture più piccole, fino al livello atomico. Henderson si dovette però scontrare con diversi ostacoli, perché all’epoca il microscopio elettronico non consentiva di osservare facilmente le biomolecole e richiedeva un campo di osservazione sottovuoto, che causava un rapido deterioramento dei campioni biologici.

La ricostruzione 3D della batteriorodopsina effettuata da Henderson, 1975
Nonostante i presupposti poco incoraggianti e le difficoltà, Henderson provò il sistema per studiare la batteriorodopsina, una proteina che si trova nella membrana di diversi microrganismi primordiali. Invece di rimuovere la proteina dal suo habitat, Henderson provò a collocare nel microscopio elettronico un’intera membrana cellulare, protetta da una goccia di soluzione con glucosio per evitare che si seccasse nel sottovuoto. Insieme ai suoi colleghi, calibrò il microscopio elettronico per “sparare” un fascio di elettroni più debole, che non deteriorasse il campione. L’immagine ottenuta non era molto nitida, ma rendeva comunque possibile calcolare come fossero orientate nello spazio le proteine. In seguito, Henderson e colleghi osservarono il campione sotto diverse angolazioni, ottenendo immagini che furono utilizzate per creare un modello tridimensionale della proteina.
Era il 1975 ed era stata ottenuta la migliore immagine 3D di una proteina mai realizzata con il microscopio elettronico. La definizione era inferiore rispetto a quella della cristallografia (0,0000003 contro 0,0000007 millimetri), ma Henderson non si diede per vinto e continuò le sue ricerche, convinto che la microscopia elettronica avesse un grande potenziale. Complici i progressi nei materiali utilizzati nei microscopi elettronici, negli anni seguenti Henderson ottenne modelli sempre più precisi e accurati della batteriorodopsina. La sua costanza e la sua perseveranza furono premiate nel 1990, quando fu in grado di presentare l’intera struttura della batteriorodopsina in 3D e a risoluzione atomica, grazie ai progressi nella microscopia crioelettronica (ci arriviamo presto). Restava però il problema di rendere il sistema di osservazione più versatile e utilizzabile per mostrare la struttura di biomolecole più complesse, orientante in modo diverso nello spazio.
Dal 2D al 3D
Henderson non era stato certo l’unico a porsi il problema. Già a partire dalla metà degli anni Settanta, Joachim Frank aveva teorizzato a New York che le poche informazioni bidimensionali raccolte da un miscroscopio elettronico, in diverse osservazioni, potessero essere fuse insieme per creare una nuova immagine tridimensionale e ad alta definizione. Impiegò dieci anni per ottenere questo ambizioso obiettivo, sviluppando un modello matematico che consentiva a un computer di riconoscere punti ricorrenti nelle varie immagini, in modo da distinguere le proteine dallo sfondo su cui giacevano. L’algoritmo migliorava la risoluzione, e con la proteina vista da diverse angolazioni. In seguito Frank trovò il modo di combinarle insieme, con un altro algoritmo, che ricostruiva un’immagine tridimensionale della proteina. Il suo sistema sarebbe stato fondamentale per lo sviluppo della crio-EM.
Acqua vetrificata
Nel frattempo, a partire dal 1978, Jacques Dubochet aveva iniziato a lavorare presso il Laboratorio europeo di biologia molecolare di Heidelberg, in Germania, con l’obiettivo di risolvere il problema alla base del microscopio elettronico: il sottovuoto, che deteriorava troppo velocemente i campioni di materiale biologico, rendendo impossibile l’osservazione delle biomolecole e delle loro interazioni. Il sistema usato da Henderson che abbiamo visto prima (quello della soluzione di glucosio per proteggere la membrana) non funzionava per le biomolecole solubili in acqua. Altri ricercatori avevano provato a congelare i campioni, perché il ghiaccio non evapora velocemente, ma i cristalli ghiacciati avevano il difetto di riflettere parte degli elettroni, rendendo inferiore la resa del microscopio.
Dubochet pensò che se fosse riuscito a trovare il modo di congelare in modo quasi istantaneo l’acqua, avrebbe ottenuto ghiaccio quasi completamente trasparente (“acqua vetrificata”) e senza i grandi cristalli che si formano col normale congelamento. Utilizzando azoto liquido a -196 °C ed etano, nel 1982 Dubochet e colleghi riuscirono a vetrificare gocce d’acqua, un risultato che fino ad allora sembrava essere impossibile (oggi sappiamo che l’acqua vetrificata è probabilmente la forma d’acqua più comune nell’Universo). Da questa intuizione di Dubochet deriva il nome microscopia criolettronica: il prefisso crio è dovuto alla parola greca κρύος, che significa “freddo, gelo”. Con l’acqua vetrificata, i ricercatori avevano infine a disposizione un sistema per osservare le biomolecole e al tempo stesso proteggerle dal microscopio elettronico e dal sottovuoto. Il progresso fu sfruttato da Henderson per i suoi nuovi modelli biomolecolari in tre dimensioni.
Una rivoluzione
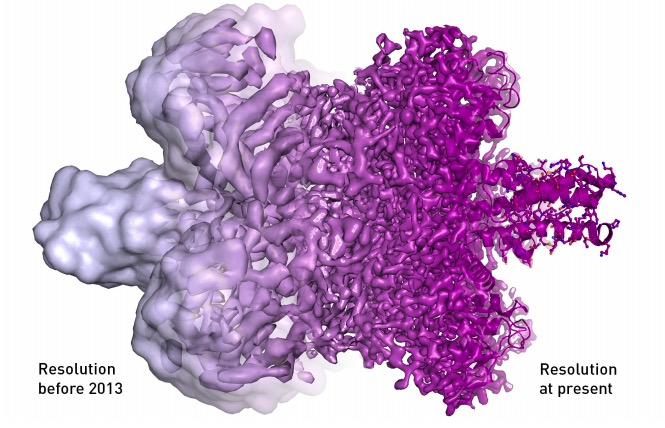
Furono però necessari quasi 30 anni di ricerche e di innovazioni tecnologiche, rese possibili grazie al lavoro di migliaia di ricercatori e grazie alle intuizioni di Dubochet, Frank ed Henderson per ottenere microscopi elettronici in grado di offrire immagini ad alta risoluzione delle biomolecole. I progressi hanno portato alla creazione di un microscopio elettronico nel 2013 che offre una risoluzione senza precedenti e che sta contribuendo a grandi avanzamenti nel campo della biochimica. Le cellule e le loro proteine possono essere osservate come mai era stato possibile prima, i ricercatori possono indagare le relazioni tra loro, il modo in cui interagiscono ed evolvono. Informazioni preziose non solo per capire come funzionano le cellule nelle loro strutture più intime, ma anche per realizzare farmaci di nuova generazione più sicuri e con minori effetti collaterali.
Jacques Dubochet è nato nel 1942 ad Aigle, Svizzera, ha conseguito il dottorato presso l’Università di Ginevra nel 1973 ed docente dell’Università di Losanna.
Joachim Frank è nato nel 1940 a Siegen, Germanoa, e ha conseguito il dottorato nel 1970 presso l’Università di Monaco. È docente presso la Columbia University di New York, negli Stati Uniti.
Richard Henderson è nato nel 1945 a Edimburgo, in Scozia (Regno Unito) e ha conseguito il dottorato nel 1969 presso la Cambridge Univeristy, dove prosegue le sue ricerche.