Un grande archivio mondiale della cacca
"Microbiota Vault" è una delle ambiziose iniziative per conservare i batteri che ci aiutano a vivere, e che stanno scomparendo

Da qualche anno numerosi campioni di feci provenienti da tutto il mondo finiscono in Svizzera. Vengono analizzati e conservati all’Università di Zurigo nell’ambito di un ambizioso progetto per catalogare e preservare i batteri che fanno parte del microbiota intestinale umano, che ha un ruolo essenziale nei processi del nostro metabolismo.
Il microbiota – che viene chiamato spesso genericamente “flora intestinale” – è estremamente vario e comprende tantissime specie batteriche, ma nei paesi più avanzati rischia di impoverirsi sensibilmente a causa delle abitudini alimentari e del grande ricorso agli antibiotici, con potenziali conseguenze sulla nostra salute. Da qui l’idea di analizzare e conservare quanti più campioni possibili, ma costruire un grande archivio della cacca è molto più difficile di quanto possa apparire balzano.
Il progetto che coinvolge l’Università di Zurigo e numerose altre istituzioni si chiama “Microbiota Vault” (la parola inglese “vault” significa “camera blindata”) ed è solo uno di numerose iniziative di questo tipo dedicate ai batteri che ci aiutano a digerire e ad assimilare gli alimenti. L’idea era stata esposta nel 2018 in un articolo pubblicato su Science, una delle riviste scientifiche più rispettate al mondo, e l’anno seguente aveva portato alla fondazione di un’organizzazione senza scopo di lucro, che si sarebbe fatta carico di esplorare la fattibilità del progetto e di gestirne le varie evoluzioni. Negli anni seguenti Microbiota Vault ha pubblicato uno studio di fattibilità e ha poi avviato la raccolta dei campioni, coinvolgendo varie università della Svizzera.
Lo scorso novembre, per esempio, uno dei gruppi di ricerca dell’iniziativa ha ricevuto a Zurigo un pacchetto proveniente dall’Etiopia contenente vari campioni di feci. Erano state raccolte nei due mesi precedenti in alcune aree rurali del paese, suddivise in apposite provette conservate poi a -80 °C per preservarne le caratteristiche. Le successive analisi avevano rivelato come vari batteri presenti nei campioni avessero sviluppato una forte resistenza agli antibiotici, nonostante le feci fossero state raccolte da persone che non erano mai entrate direttamente in contatto con gli antibiotici che possiamo trovare in farmacia o in ospedale.

Gli Yanomamö appartengono a un gruppo etnico che vive in un’area compresa tra i fiumi Orinoco e Rio delle Amazzoni, sono tra le popolazioni studiate per la diversità del loro microbiota (AP Photo/Ariana Cubillos, File)
Questa circostanza, che si verifica con campioni provenienti anche da altre parti del mondo, mostra come sia sempre più difficile trovare un microbiota non “contaminato”. In oltre un secolo di utilizzo, gli antibiotici hanno permesso di salvare milioni di vite e di trattare malattie un tempo incurabili, ma l’impiego su grande scala di antibiotici a largo spettro ha fatto sì che mutazioni del tutto casuali favorissero quei batteri che avevano la capacità di resistere agli antibiotici. Oggi la cosiddetta “antibiotico-resistenza” è un grande problema in ambito sanitario, tanto da avere spinto le principali istituzioni sanitarie e i governi a tenere più sotto controllo l’utilizzo degli antibiotici. Svilupparne di nuovi è costoso e sempre più difficile, c’è quindi il rischio che in futuro gli antibiotici di cui disponiamo non saranno più in grado di contrastare alcuni batteri.
Gli antibiotici sono utilizzati non solo negli esseri umani, ma anche negli allevamenti di animali. Vengono dispersi nell’ambiente direttamente o indirettamente (talvolta attraverso le feci e le urine, per esempio), finiscono nei corsi d’acqua e possono entrare poi in contatto con altri esseri umani. Siamo esposti di frequente agli antibiotici, provenienti da varie fonti, e questo spiega probabilmente perché siano ritrovati in campioni prelevati da individui che vivono nei luoghi più remoti del pianeta.
Tendiamo a immaginare un batterio come un nemico, qualcosa di cui occorra liberarsi il prima possibile, ma in realtà non tutti i batteri vengono per nuocere, come dimostra il nostro microbiota. Si è co-evoluto con noi nel corso di molto tempo e svolge un ruolo molto importante per la nostra salute in un processo simile alla simbiosi: abbiamo bisogno dei suoi batteri per il metabolismo e i suoi batteri hanno bisogno di noi per proliferare. Molti aspetti del microbiota e del modo in cui si forma nei feti durante la gravidanza non sono ancora completamente chiari, ma dopo anni di studi iniziamo ad avere qualche indizio.
Si ritiene che la scintilla che avvia la formazione del microbiota vero e proprio avvenga al momento della nascita, quando si è esposti ai numerosi batteri che si trovano nel canale uterino. Il processo di formazione prosegue nei mesi successivi attraverso l’allattamento e il contatto con i primi alimenti solidi, che proprio come il latte materno contengono sostanze che non possono essere digerite autonomamente dall’organismo. In questa fase, il microbiota sembra abbia un ruolo molto importante anche nella formazione delle prime difese immunitarie. Si sviluppano batteri innocui e utili per la nostra salute in varie parti dell’organismo, non solo nell’intestino, dove però la loro presenza è più facile da rilevare ed è molto importante per i processi digestivi.
Il microbiota influenza le funzioni metaboliche, contribuisce a proteggerci da particolari tipi di infezioni, digerisce composti che da solo il nostro organismo non riuscirebbe a scindere in sostanze più semplici da assimilare, mantiene una forte relazione con il sistema immunitario e contribuisce ai meccanismi di produzione dei neurotrasmettitori, fondamentali per alcune funzioni neurologiche e regolatrici del comportamento.
Per i gruppi di ricerca che se ne occupano, raccogliere campioni di feci da tutto il mondo è molto importante perché non esiste un solo tipo di microbiota. Quello delle popolazioni in Tanzania, in Amazzonia o nel Malawi è sensibilmente diverso da quello delle popolazioni occidentali o asiatiche.

(AP Photo/Sakchai Lalit)
Le abitudini alimentari sono tra le principali cause di questa diversità: è più probabile trovare batteri specializzati nella digestione di vegetali a fibre lunghe nelle popolazioni che vivono a più stretto contatto con la natura rispetto a quelle occidentali, dove c’è in media un consumo più alto di cibo processato. E proprio le popolazioni nei paesi più avanzati sembra abbiano sviluppato un microbiota molto diverso da quello delle popolazioni rurali, che mantengono maggiori similitudini nei batteri del loro apparato digerente anche se vivono in luoghi molto diversi e senza venire in contatto tra loro.
Le cause di questa differenziazione non sono ancora completamente chiare, ma vari gruppi di ricerca ritengono che sia proprio durante le ultime fasi della gravidanza che si avvii questo processo, per esempio con pratiche mediche come la somministrazione di antibiotici in fase prenatale, tagli cesarei e il ricorso al latte in polvere rispetto a quello materno: tutte pratiche mediche importanti diffuse nei paesi avanzati e talvolta inevitabili per garantire la salute del feto e della madre, ma che possono avere altri tipi di conseguenze. Alcune ricerche hanno inoltre segnalato come i bambini che ricevono cure con antibiotici nei primi due anni di vita siano più esposti al rischio di sviluppare allergie, asma, irritazioni e malattie infiammatorie croniche intestinali. È bene comunque ricordare che in alcune circostanze il ricorso agli antibiotici nei primi anni di vita è inevitabile, se si devono trattare malattie che potrebbero avere esiti invalidanti o letali.
Nelle società occidentali la differenziazione del microbiota prosegue nelle fasi dello sviluppo, in parallelo con una dieta solitamente ricca di carboidrati, zuccheri, grassi saturi e con un basso apporto di fibre e di alimenti freschi come frutta e verdura. Nell’intestino si determina una inevitabile selezione dei batteri, con alcuni che via via scompaiono perché non possono fare affidamento sulle sostanze da digerire verso cui sono specializzati, indebolendosi e non riuscendo a competere con altre specie di batteri.
Alcuni studi hanno rilevato come questa selezione dovuta alla dieta abbia ripercussioni anche nelle generazioni successive, almeno in alcuni test effettuati sugli animali, dove si possono studiare con relativa rapidità gli effetti tra più generazioni. La perdita di diversità del microbiota avviene in modo piuttosto rapido ed è stata osservata anche tra gli individui che migrano da paesi poveri verso quelli più sviluppati. Entro una generazione, il rischio di sviluppare condizioni come infiammazioni croniche intestinali è sostanzialmente uguale tra le famiglie di migranti e quelle originarie dei paesi più ricchi.
Proprio perché la perdita di diversità è così rapida e scarsamente reversibile, vari gruppi di ricerca stanno studiando il modo per conservare il microbiota per le generazioni future. I batteri e i campioni di feci potrebbero rivelarsi molto importanti per sviluppare nuovi farmaci e terapie, o per altri scopi che oggi non riusciamo nemmeno a immaginare.
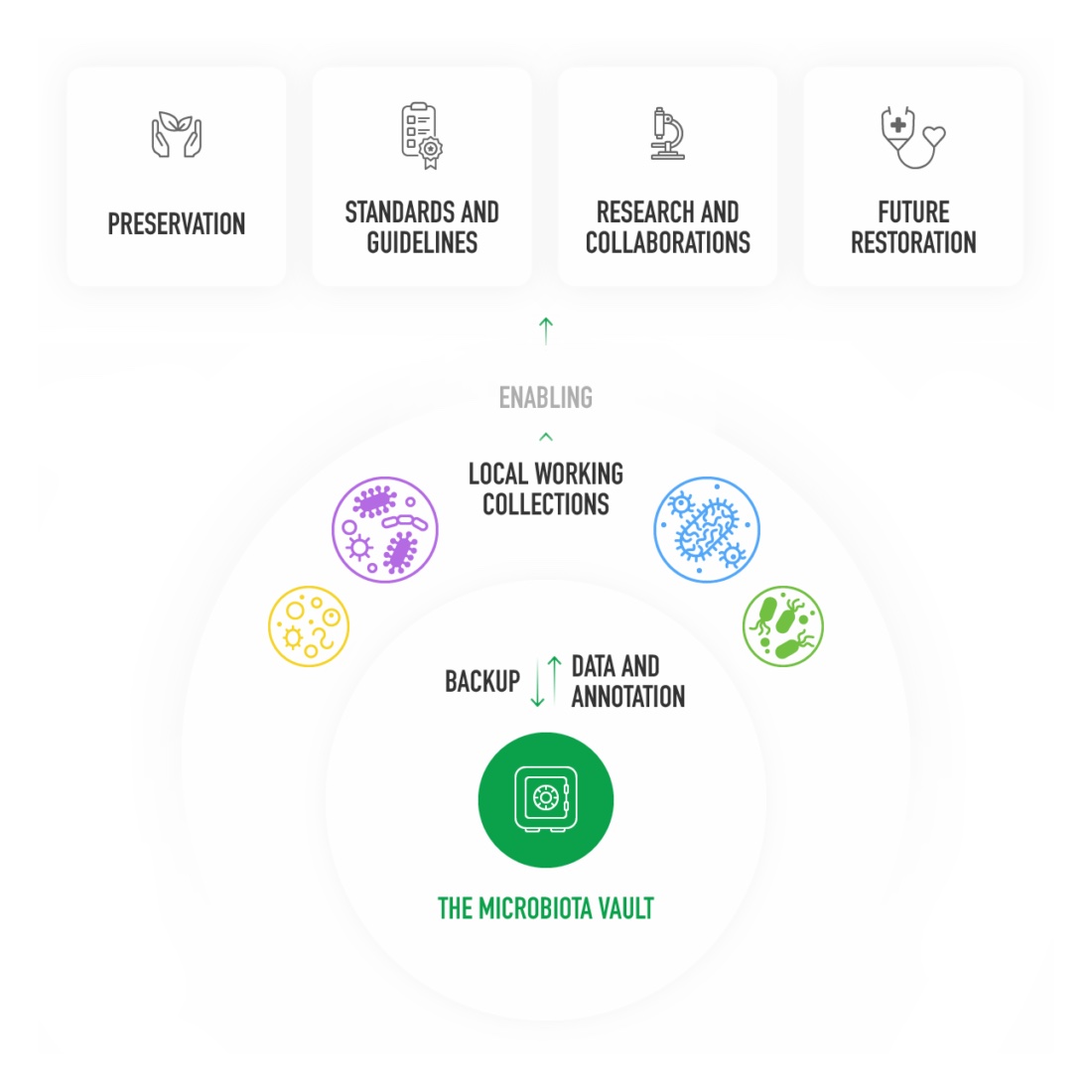
(Microbiota Vault)
Una volta completato, il Microbiota Vault potrebbe conservare decine di migliaia di campioni di feci, donati da altrettante persone che vivono in un quartiere di Zurigo, in una megalopoli come Pechino, in un villaggio in Islanda o in una remotissima comunità in Amazzonia. Come in alcuni altri progetti, i responsabili di Microbiota Vault hanno adottato regole che dovrebbero incentivare vari gruppi di ricerca a partecipare all’iniziativa. L’idea di base è che chiunque sia al lavoro su campioni di feci per vari tipi di ricerca trattenga per il proprio laboratorio parte del campione, in modo da poter condurre le proprie analisi, e doni ciò che rimane al Microbiota Vault per metterlo al sicuro e conservarlo a tempo indefinito.
Oltre a essere archiviato con informazioni sul luogo di provenienza e il periodo in cui è stato effettuato il prelievo, ogni campione sarà catalogato con informazioni sulle caratteristiche genetiche dei batteri che lo costituiscono, in modo da avere un unico grande database aperto alla consultazione da parte dei gruppi di ricerca. È un progetto molto ambizioso e, come per altre iniziative simili, non mancano le difficoltà da superare.
Al momento, per esempio, non esiste ancora il luogo in cui saranno conservate le feci per le generazioni future. Per ora buona parte dei campioni viene conservata in un congelatore all’Università di Zurigo, in attesa che Microbiota Vault sviluppi la parte operativa del progetto. Il coinvolgimento di numerosi istituti di ricerca ha permesso di ottenere un finanziamento di circa 1 milione di euro, che dovrebbe coprire i costi almeno fino al 2024. Nel momento in cui sarà trovata la sede per archiviare le feci, i costi aumenteranno notevolmente.
I responsabili del progetto hanno buoni rapporti con la Svizzera, dove è basata buona parte della loro attività di ricerca, e con la Norvegia, paese che ha una certa esperienza nella gestione di grandi archivi biologici come dimostra il suo centro per la conservazione dei semi alle isole Svalbard. In Svizzera i campioni di feci potrebbero essere conservati inizialmente in alcune biobanche, cioè in strutture che raccolgono e archiviano materiale biologico a fini di ricerca già esistenti e ben avviate.
In seguito, Microbiota Vault vorrebbe ricorrere a una propria struttura, unica e ben protetta per garantire la sicurezza dei campioni per lungo tempo. Le ricognizioni in Svizzera hanno interessato soprattutto bunker costruiti a scopi militari e ormai dismessi, che potrebbero essere riadattati per ospitare i campioni e offrire un buon grado di protezione. La Svizzera è inoltre considerata una nazione ideale, considerato il proprio ruolo di paese neutrale ormai da secoli, ma l’archivio delle feci dovrebbe essere mantenuto costantemente a temperature molto basse, cosa che ne garantirebbe meno la sostenibilità nel lungo periodo.

Lo Svalbard Global Seed Vault visto da fuori, nell’aprile 2015 (Jens Büttner/picture-alliance/dpa/AP Images)
La scelta non sarà infatti condizionata solamente da valutazioni politiche e dalle disponibilità mostrate dai due paesi, ma anche dai vincoli posti dalla corretta conservazione dei campioni. Questi potrebbero essere conservati ad almeno -80 °C (“crioconservazione”) con vari sistemi di refrigerazione, oppure attraverso un processo di liofilizzazione, che richiederebbe una minore manutenzione dell’archivio considerato che al termine del processo non occorrono temperature molto basse per conservare i campioni.
Sono entrambi metodi utilizzati in vari contesti di archiviazione di materiale biologico, ma i responsabili dell’iniziativa vogliono capire quale sia la soluzione più adatta. Hanno conservato alcuni campioni e sono in attesa che trascorrano due anni per effettuare nuovi test e verificare se a distanza di qualche tempo possano essere analizzati geneticamente (sequenziati) senza problemi, e soprattutto senza perdita di informazioni.
Non tutti i batteri reagiscono allo stesso modo quando vengono esposti all’ossigeno, alcuni non riescono proprio a sopravvivere in presenza di particolari concentrazioni di questo elemento. Per questo i campioni devono essere raccolti e congelati il prima possibile, anche nel caso in cui sia prevista un’analisi di laboratorio pochi giorni dopo. Mantenere i batteri vivi è essenziale per poterne produrre colonie durante le sperimentazioni, in modo da avere più esemplari da utilizzare per gli studi e le analisi genetiche. Deve quindi passare poco tempo dalla raccolta delle feci al momento in cui vengono congelate, con tutte le difficoltà conseguenti se ci si trova in aree particolarmente remote e di difficile accesso.
Lo sanno bene i gruppi di ricerca che collaborano da anni alla Global Microbiome Conservancy (GMbC), un’altra iniziativa per studiare e conservare il microbiota nata da una collaborazione in Germania e che ha subìto poi varie evoluzioni fino a rientrare in OpenBiome. L’iniziativa senza scopo di lucro era stata avviata nel Massachusetts dieci anni fa ed è dedicata anche agli aspetti terapeutici, legati per esempio ai trapianti di feci, una nuova tecnica sperimentale che sembra essere molto promettente per trattare vari problemi di salute.
We’re excited to announce our expanded mission to catalyze microbiome research on a global scale!
Learn more about OpenBiome’s unique research tools and platform for inclusive science in our press release: https://t.co/LEq3xaQyq2 pic.twitter.com/EpFmidaQao— OpenBiome (@OpenBiome) October 27, 2022
Come hanno spiegato i responsabili di GMbC, il lavoro sul campo per raccogliere i campioni deve tenere in considerazione aspetti culturali ed etici, legati alle popolazioni con cui si entra in contatto. In passato, alcune comunità indigene furono sfruttate malamente e senza particolari precauzioni a fini di ricerca, cosa che ha provocato una certa diffidenza da parte dei loro componenti verso i gruppi di ricerca che arrivano per studiarli. GMbC ha sviluppato un proprio codice etico che garantisca sia i donatori sia l’uso che verrà fatto dei campioni di feci, sui quali non è consentito lucrare direttamente.
Come in molti altri ambiti di ricerca, il tempo è ciò che determina più di tutto il lavoro di raccolta e catalogazione dei campioni. Oltre al breve periodo, con le necessità di conservare da subito al meglio i campioni, ci sono aspetti legati al medio-lungo periodo e alla possibilità stessa di poter proseguire nella raccolta di campioni di feci significativi e con poche contaminazioni.
Le Nazioni Unite stimano che entro il 2050 quasi il 70 per cento della popolazione mondiale vivrà nelle città, di conseguenza molte persone che oggi vivono in aree rurali cambieranno radicalmente le proprie abitudini di vita e con queste cambierà anche la composizione del loro microbiota. La quantità di persone con problemi di salute riconducibili a questo cambiamento aumenterà sensibilmente e per questo sarà ancora più importante mantenere traccia di come stessero le cose in precedenza e di renderle disponibili alle prossime generazioni.



