L’antibiotico-resistenza è un gran problema
Il massiccio uso di antibiotici ha contribuito a rendere molto più resistenti i batteri, con gravi rischi per la salute in tutto il mondo

Il recente annuncio dello sviluppo del zosurabalpin – un antibiotico di nuova generazione ritenuto efficace contro un batterio molto difficile da trattare – è stato accolto come un nuovo importante progresso nell’affrontare il problema dell’antibiotico-resistenza, cioè della capacità di alcuni batteri di resistere ai farmaci e di portare avanti l’infezione talvolta con esiti letali. Il fenomeno è noto da tempo e secondo l’Organizzazione mondiale della sanità (OMS) è uno dei più grandi rischi per la salute pubblica perché, con il passare del tempo, rende sempre meno efficaci farmaci che nel corso del Novecento avevano permesso di salvare la vita di milioni di persone.
In generale gli antibiotici sono sostanze prodotte da un microrganismo in grado di ucciderne un altro o di limitarne la moltiplicazione. Gli antibiotici propriamente detti sono quelli prodotti in questo modo da alcuni microrganismi per contrastarne altri, mentre gli antibatterici non-antibiotici sono sostanze ottenute in laboratorio. Entrambi hanno comunque la medesima caratteristica, cioè uccidere o prevenire la crescita di particolari batteri, di conseguenza si utilizza comunemente il termine ombrello “antibiotici” per tutte e due le tipologie di sostanze.
Lo sviluppo degli antibiotici, a partire dai primi esperimenti di Alexander Fleming sulla penicillina alla fine degli anni Venti del secolo scorso, ha portato all’identificazione di circa 15 classi dalle quali è derivata la produzione degli antibiotici che utilizziamo ancora oggi. La varietà di queste sostanze non è molto ampia e questa scarsità è diventata una delle cause dell’antibiotico-resistenza, insieme a un uso su ampia scala e spesso eccessivo degli antibiotici nella seconda metà del Novecento.
Una certa resistenza antibiotica da parte dei batteri è sempre esistita ed è stata essenziale per scoprire gli antibiotici che utilizziamo. I batteri sono organismi unicellulari e devono difendersi dagli agenti esterni, che potrebbero danneggiarli e compromettere le loro colonie. Per farlo nel corso di milioni di anni hanno sviluppato la capacità di produrre propri antibiotici, cioè sostanze che danneggiano per esempio altre specie di batteri, che altrimenti potrebbero distruggerli e rimpiazzarli. È un processo che riguarda anche i funghi e fu alla base dei primi lavori di Fleming, che derivò la penicillina proprio da una muffa (le muffe appartengono al regno dei funghi).
Lo studio dei batteri e delle loro difese ha portato allo sviluppo di una grande varietà di antibiotici: alcuni sono ad ampio spettro, cioè contrastano specie diverse di batteri, mentre altri sono più specializzati verso una sola o poche specie di questi microrganismi. Le diverse tipologie di antibiotici servono appunto per provare a eludere le difese dei batteri ed eliminarli, in modo da aiutare il sistema immunitario del paziente a superare l’infezione.
I batteri si riproducono di continuo, anche più volte in una sola ora, e lo fanno copiando il loro materiale genetico. In questo processo può accadere che si verifichino delle mutazioni, cioè degli errori nel processo di copiatura del materiale genetico. La maggior parte delle mutazioni è innocua e non ha conseguenze, ma alcune possono invece determinare una maggiore resistenza del batterio a uno o più antibiotici. Un trattamento con antibiotici elimina quindi i batteri senza la mutazione, mentre si rivela inefficace contro quelli che casualmente hanno sviluppato una certa resistenza. Questi possono a loro volta mutare, producendo batteri dotati di un ulteriore tipo di resistenza e rendendo quindi ancora più difficile la loro eliminazione con gli antibiotici.
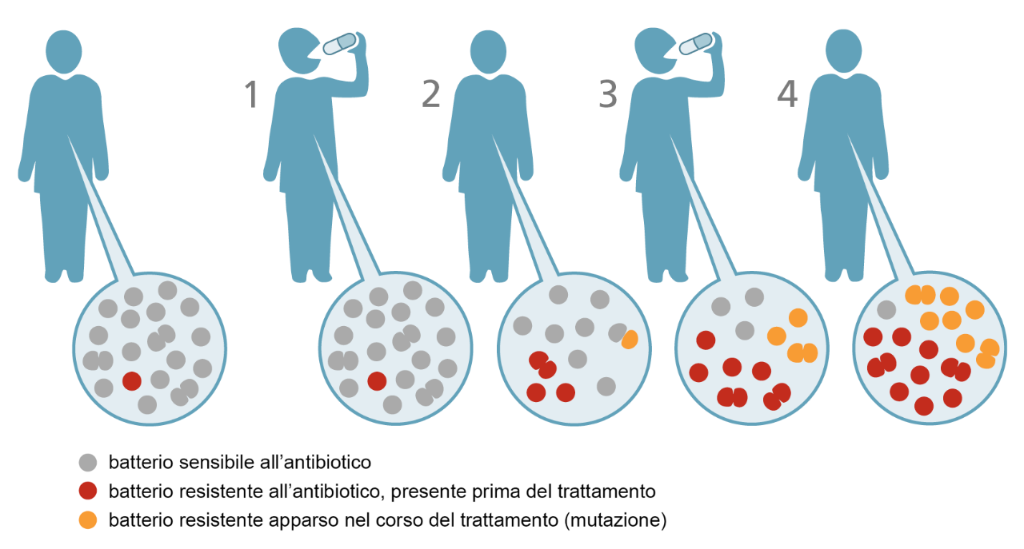
Esempio semplificato di sviluppo dell’antibiotico-resistenza (Ufficio federale della sanità pubblica della Confederazione Svizzera)
I batteri resistono agli antibiotici in modo diverso a seconda del modo in cui sono fatti e delle mutazioni che hanno accumulato. Alcuni espellono semplicemente l’antibiotico che si è inserito nel materiale cellulare, mentre altri rendono impermeabile la loro membrana in modo che l’antibiotico non possa andare oltre. Ci sono altri casi in cui i batteri modificano la struttura dell’antibiotico rendendolo inattivo oppure ancora modificano alcune delle proteine batteriche e sulle quali sarebbe dovuto intervenire l’antibiotico.
Come abbiamo visto l’antibiotico-resistenza è una caratteristica tipica dei batteri legata al modo in cui mutano ed evolvono, tuttavia un uso eccessivo o inappropriato degli antibiotici può facilitare l’emergere di batteri sempre più resistenti. Gli antibiotici vengono spesso utilizzati in modo poco o per nulla adeguato, spesso per trattare malattie che non sono causate da batteri, ma da virus contro i quali un antibiotico non può fare nulla. Una certa tendenza a ricorrere agli antibiotici senza motivo era emersa piuttosto chiaramente nelle fasi più acute della pandemia da coronavirus, nonostante tutte le principali istituzioni internazionali invitassero a non utilizzare questo tipo di farmaci per trattare COVID-19, una malattia virale a tutti gli effetti.
L’antibiotico-resistenza può anche essere favorita da un uso scorretto degli antibiotici, per esempio quando si decide di accorciare la durata della terapia, oppure di ridurre le dosi di antibiotico e di fare da sé, senza avere consultato un medico. L’effetto della maggior parte degli antibiotici è relativamente breve e per questo le terapie spesso prevedono l’assunzione di una dose due o tre volte al giorno, per avere una copertura completa durante il trattamento. Assumerne meno o in orari non regolari può facilitare la sopravvivenza dei batteri e la loro proliferazione, con un aumentato rischio di mutazioni.
I batteri che sviluppano una marcata resistenza possono causare numerose tipologie di infezioni, che possono diventare croniche o nei casi più gravi letali. Tra le infezioni più ricorrenti e difficili da trattare ci sono quelle del tratto urinario, le polmoniti, le infezioni della pelle, alcune forme di diarrea e le infezioni a carico del sistema circolatorio. Le persone ricoverate in ospedale sono inoltre a più alto rischio di contrarre infezioni batteriche, a cominciare da quelle da Acinetobacter baumannii, un batterio che può avere una forte resistenza agli antibiotici, compresi i carbapenemi, una classe di antibiotici ad ampio spettro di azione e che vengono considerati di “ultima linea” (cioè trattamenti da adottare quando gli altri hanno fallito).
Trattare le infezioni dovute a batteri resistenti è spesso molto difficile e rende necessaria la somministrazione di tipi diversi di antibiotici, che possono essere via via più potenti e mirati, ma anche più costosi. Trovare la giusta terapia richiede tempo in una fase in cui qualsiasi ritardo è un problema per il paziente, che continua intanto a peggiorare a causa dell’avanzare dell’infezione e degli altri problemi connessi. Le complicazioni possono rivelarsi letali, soprattutto nel caso dei ceppi batterici che si rivelano resistenti a più classi diverse di antibiotici. Il rischio è che con il tempo alcuni batteri diventino resistenti a tutti gli antibiotici oggi disponibili, vanificando i progressi raggiunti nel Novecento in questo campo.
I dati raccolti dal Centro europeo per la prevenzione e il controllo delle malattie (ECDC) indicano che l’antibiotico-resistenza sta diventando un problema in molti paesi dell’Europa. In particolare negli ultimi anni è stato osservato un aumento della resistenza di Escherichia coli agli antibiotici solitamente più usati, con un conseguente aumento dei casi di infezioni croniche al tratto urinario e infezioni ancora più gravi. Nei paesi meridionali dell’Europa il fenomeno sembra essere più diffuso rispetto ai paesi della Scandinavia e ai Paesi Bassi. In generale, i paesi dove storicamente si registra un ricorso più prudente agli antibiotici sono anche i paesi dove il fenomeno della resistenza agli antibiotici è meno presente.
Il problema dell’uso eccessivo degli antibiotici è comunque globale e l’OMS ha avviato diverse iniziative e progetti per sensibilizzare i governi e le autorità sanitarie nazionali sul problema, con ripetuti inviti a ridurre l’impiego degli antibiotici. In molti paesi, compresa l’Italia, sono state rafforzate le limitazioni legate alla possibilità di acquisto degli antibiotici in farmacia senza una prescrizione medica proprio per evitare gli approcci fai-da-te.
Gli antibiotici non sono consumati solo direttamente dagli esseri umani, ma anche indirettamente attraverso la catena alimentare. Negli allevamenti si fa spesso ampio uso degli antibiotici per assicurarsi una crescita rapida e in salute degli animali, riducendo il rischio di infezioni. Le sostanze utilizzate sono le medesime impiegate sugli esseri umani e ci sono studi che hanno rilevato un effettivo passaggio di alcune di queste in chi consuma carne. Le ricerche in tema sono ancora in corso, ma si ritiene che il trasferimento sia minimo se confrontato con quello dovuto ai trattamenti medici negli esseri umani.
Un uso solo quando strettamente necessario degli antibiotici ed esami diagnostici più accurati per stabilire in fretta la giusta terapia antibiotica sono considerati gli strumenti più importanti per contenere il problema dell’antibiotico-resistenza. Ma secondo l’OMS un approccio integrato deve anche passare attraverso lo sviluppo di antibiotici di nuova generazione, in modo da trattare i casi più difficili come quelli da Acinetobacter baumannii. Come ha segnalato un recente editoriale pubblicato dalla rivista scientifica Nature, sviluppare nuovi antibiotici non è semplice e ha forti implicazioni economiche.
Si stima che solo un candidato antibiotico su 30 superi la fase di verifica in laboratorio per poi iniziare i test sui pazienti. L’intero processo dallo sviluppo all’approvazione da parte delle autorità di controllo può arrivare a costare intorno a un miliardo di euro, ma poiché si cerca di utilizzare il meno possibile gli antibiotici proprio per evitare l’antibiotico-resistenza i ritorni per l’azienda farmaceutica che ha investito così tanto sono generalmente bassi, spesso inferiori ai 100 milioni di euro all’anno. Di conseguenza le aziende farmaceutiche sono restie a fare grandi investimenti nel settore, salvo non ci siano incentivi e promesse di acquisto da parte dei governi tali da rendere sostenibile la loro attività di ricerca e sviluppo.
La questione sarà affrontata nel corso della prossima assemblea generale delle Nazioni Unite a settembre, con una serie di incontri dedicati alla resistenza agli antimicrobici (il problema riguarda anche, in modo diverso, i funghi e i virus) dopo gli ultimi organizzati ormai otto anni fa. Gli incontri di questo tipo servono di solito a fissare impegni e regole comuni, ma anche per fare il punto della situazione dopo la prima serie di iniziative adottate nel 2016 da oltre 150 paesi per ridurre e rendere più responsabile il consumo di antibiotici.



