Il Nobel per la Chimica a Emmanuelle Charpentier e Jennifer A. Doudna
Per avere sviluppato il sistema di editing del genoma CRISPR/Cas9 per modificare pezzi di materiale genetico con grande precisione
di Emanuele Menietti – @emenietti

Il Premio Nobel per la Chimica è stato assegnato oggi a Emmanuelle Charpentier e Jennifer A. Doudna “per avere sviluppato un sistema di editing del genoma”. Il sistema CRISPR/Cas9, sviluppato dalle due ricercatrici, ha messo a disposizione una nuova potente soluzione per cambiare il DNA degli animali, delle piante e di altri microorganismi, con una precisione senza precedenti. Questo sistema ha permesso negli ultimi anni di sviluppare nuove terapie contro i tumori e potrebbe rendere possibile la cura di diverse malattie ereditarie.
Un’enorme guerra
Anche se non ce ne rendiamo conto, da quando esiste la vita batteri e virus si fanno una guerra senza quartiere, dandosele di santa ragione. I batteriofagi (o fagi), per esempio, sono particolari virus che vanno a caccia di batteri. Si stima che da soli ogni giorno uccidano il 40 per cento circa dei miliardi di miliardi di batteri che vivono negli oceani (se ne formano di nuovi miliardi quotidianamente).
Dopo che sono entrati in contatto con i batteri, i fagi iniettano il proprio materiale genetico al loro interno, trasformandoli in piccole fabbriche che produrranno altri virus, che a loro volta infetteranno altri batteri. A differenza degli organismi più complessi e con un sistema immunitario avanzato, come il nostro, i batteri hanno meno difese e falliscono quasi sempre a resistere.
Talvolta accade però che alcuni batteri riescano a resistere all’attacco da parte dei batteriofagi. Quando ciò avviene, salvano parte del materiale genetico del virus nel loro codice genetico, in una sorta di catalogo che i ricercatori chiamano CRISPR, da clustered regularly interspaced short palindromic repeats (brevi ripetizioni palindrome raggruppate e separate a intervalli regolati).
Se in seguito entra nuovamente in contatto con un virus, il batterio produce una copia del materiale genetico che aveva archiviato e la passa a una proteina che si chiama Cas9. Questa si mette al lavoro e cerca all’interno del batterio pezzi di DNA e li confronta con quelli in archivio, per capire se sia presente un virus. Nel caso in cui rilevi una corrispondenza, provvede a tagliare la sequenza genetica appartenente al virus, rendendola in questo modo innocua. In mancanza di istruzioni chiare, il batterio non può essere trasformato in una fabbrica di nuovi virus e non rischia di fare una brutta fine.
Editing
La Cas9 è una proteina estremamente precisa nel tagliare pezzi di DNA. Quando Chapentier e Doudna se ne accorsero nel corso dei loro studi – mettendo insieme le conoscenze raccolte separatamente in anni di ricerca e con altri ricercatori – si chiesero se potessero sfruttare Cas9 per programmare il sistema CRISPR e utilizzarlo per fare editing del materiale genetico. L’obiettivo piuttosto ambizioso non le scoraggiò e portò alla creazione di un sistema di “forbici genetiche” descritto nel loro studio pubblicato nel 2012.
Semplificando molto, le forbici di CRISPR/Cas9 per modificare il materiale genetico in una cellula funzionano partendo da una sequenza genetica (RNA guida) approntata dai ricercatori che corrisponde a quella del DNA dove si deve effettuare il taglio nella cellula. La proteina Cas9 si mette all’opera ed effettua il taglio: se non ci sono altre istruzioni, le cellula ripara il proprio DNA perdendo un pezzo del proprio codice genetico, comportando la perdita delle istruzioni per il gene che i ricercatori volevano disattivare. Il sistema consente inoltre di innestare del nuovo DNA nella fase di riparazione, nel caso in cui i ricercatori vogliano modificare ulteriormente il funzionamento della cellula.
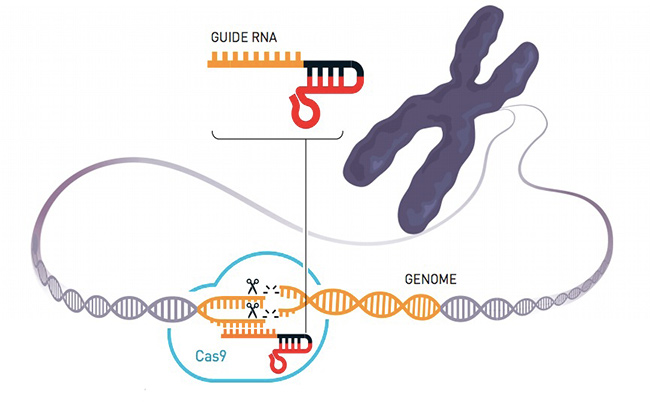
(Nobelprize.org)
Opportunità e pericoli
Prima dell’avvento di CRISPR/Cas9, modificare i geni in una cellula era estremamente difficile, richiedeva molto tempo e spesso portava a risultati poco affidabili. Grazie alle forbici genetiche, invece, si possono effettuare modifiche molto più accurate e in tempi più rapidi. Il sistema è ormai diffuso in numerosi ambiti della ricerca, anche se non è sempre facile da padroneggiare e ha mostrato di avere la necessità di qualche miglioramento.
I ricercatori in questi anni hanno utilizzato CRISPR/Cas9 soprattutto per comprendere meglio il funzionamento dei geni e le loro interazioni, per esempio nel caso di malattie in alcuni animali. La tecnica è impiegata anche per modificare il genoma delle piante, in modo da renderle più resistenti alla siccità, oppure a particolari parassiti, riducendo la necessità di utilizzare composti chimici potenzialmente dannosi per la nostra salute.
CRISPR/Cas9 è ritenuta inoltre una risorsa molto promettente per sviluppare nuove cure contro alcune malattie ereditarie, anche se i risultati ottenuti per ora sono ancora parziali e le tecniche da affinare. I ricercatori stanno anche sperimentando l’impiego di CRISPR per modificare le nostre cellule immunitarie, rendendole in grado di andare a caccia delle cellule tumorali con maggiore efficacia.
Un sistema così accurato di modifica del genoma apre inoltre scenari ancora inesplorati ed eticamente controversi. In linea teorica, CRISPR/Cas9 potrebbe essere impiegato per creare esseri umani geneticamente modificati. Potrebbe offrire enormi benefici per ridurre i rischi di nascite con gravi malattie ereditarie, ma potrebbe anche portare a modifiche irreversibili del nostro patrimonio genetico, trasmesso di generazione in generazione. Siamo ancora molto distanti da queste eventualità, ma proprio per questo motivo molti invitano a non sottovalutare un dibattito centrale e in un certo senso esistenziale.
Emmanuelle Charpentier è nata nel 1968 a Jubisy-sur-Orge in Francia ed è direttrice della Divisione per le scienze dei patogeni presso il Max Planck Institute di Berlino, in Germania.
Jennifer A. Doudna è nata nel 1964 a Washington, DC (Stati Uniti) ed è docente presso l’Università della California, Berkeley.



