Il Nobel per la Chimica per le batterie ricaricabili agli ioni di litio
John B. Goodenough, M. Stanley Whittingham e Akira Yoshino sono stati premiati per avere sviluppato una tecnologia che usiamo tutti i giorni e dal grande potenziale

Il premio Nobel per la Chimica 2019 è stato assegnato a John B. Goodenough, M. Stanley Whittingham e Akira Yoshino “per lo sviluppo delle batterie agli ioni di litio”. Con le loro ricerche hanno dato un contributo fondamentale allo sviluppo delle batterie ricaricabili che usiamo tutti i giorni, nei nostri smartphone, nei computer portatili e in migliaia di altri dispositivi di vario tipo. Le batterie agli ioni di litio sono inoltre considerate una possibile soluzione per lo sviluppo di automobili elettriche e per la conservazione dell’energia in eccesso prodotta dalle fonti rinnovabili.
Il litio fu scoperto all’inizio del Diciannovesimo secolo, ed è l’elemento allo stato solido più leggero della tavola periodica. Nei primi anni Settanta del Ventesimo secolo, Stanley Wittingham sviluppò una prima batteria elettrica che utilizzava il litio. Una decina di anni dopo, John Goodenough ne aumentò il potenziale, aprendo la strada a batterie di quel tipo più potenti. A metà degli anni Ottanta, Akira Yoshino riuscì a perfezionare ulteriormente il sistema: eliminò l’impiego del litio allo stato puro, impiegando al suo posto gli ioni di litio, molto più sicuri. L’evoluzione delle batterie agli ioni di litio ha avuto un impatto enorme sulle nostre esistenze, rendendo possibile la produzione di dispositivi ricaricabili che possiamo portare con noi.
Anche se ancora oggi i mezzi di trasporto a motore più diffusi sono quelli che si alimentano con combustibili fossili, già intorno alla metà del secolo scorso divenne evidente che in futuro l’umanità avrebbe dovuto fare affidamento su sistemi alternativi e meno inquinanti per muoversi. La ricerca di fonti di energia alternative e di veicoli elettrici si scontrò con la scarsa disponibilità di tecnologie adatte per accumulare l’energia elettrica. All’epoca c’erano sostanzialmente solo due tipi di batterie ricaricabili: quelle al piombo-acido, inventate nel 1859 (e che usiamo ancora nelle auto diesel e a benzina) e quelle al nichel-cadmio, sviluppate invece all’inizio del Novecento.
Tra le prime grandi aziende a voler sperimentare soluzioni alternative ci fu Exxon, grande compagnia petrolifera statunitense, interessata a diversificare le proprie attività in vista di un futuro senza petrolio. L’azienda assunse decine di tecnici, ingegneri e chimici per occuparsi dell’energia elettrica e dello studio di soluzioni alternative ai combustibili fossili. Tra loro c’era anche Whittingham, che aveva iniziato a lavorare per Exxon nei primi anni Settanta, dopo avere studiato presso la Stanford University occupandosi di materiali solidi con trame contenenti spazi piccoli quanto atomi, nei quali si potevano attaccare gli ioni (intercalazione; uno ione è un atomo con carica elettrica positiva o negativa, a seconda che abbia perso o acquistato elettroni).
L’intercalazione fa sì che le proprietà del materiale cambino quando questo cattura al suo interno degli ioni. Whittingham si interessò alla faccenda, studiando alcuni materiali superconduttori, e valutando come cambiasse la loro conducibilità elettrica se si aggiungevano degli ioni. Scoprì che gli ioni di potassio condizionavano la conducibilità del solfuro di tantalio, un materiale superconduttore su cui osservò un’alta densità energetica. Nelle ricerche seguenti, Whittingham provò a sostituire il materiale con qualcosa di più leggero come il titanio, ritenendo che una batteria al tantalio sarebbe stata troppo pesante per i veicoli.
E qui entra in scena per la prima volta il litio, come elettrodo negativo nella nuova batteria cui stava lavorando Whittingham. Semplificando, in una batteria gli elettroni dovrebbero fluire dall’elettrodo negativo (anodo) a quello positivo (catodo). L’anodo deve essere quindi costituto da un materiale che favorisca il cedimento degli elettroni e il litio è proprio uno di quelli che lo fa più volentieri. Whittingham era finalmente riuscito a realizzare una batteria promettente, con grande soddisfazione di Exxon che decise di metterla in produzione il prima possibile.
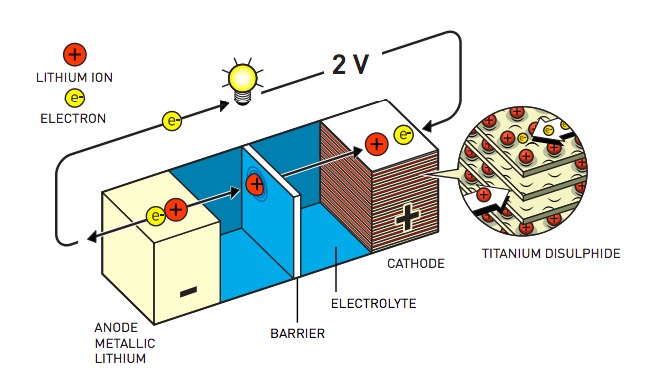
La batteria al litio sviluppata da Whittingham (©Johan Jarnestad/The Royal Swedish Academy of Sciences)
Le cose però non andarono liscissime. Nelle successive fasi di sviluppo, Whittingham e colleghi scoprirono che, ricarica dopo ricarica, sull’anodo si formavano piccole concrezioni di litio simili a stalattiti, che crescevano fino a raggiungere il catodo creando un cortocircuito all’interno della batteria, che quindi… esplodeva. Solo l’aggiunta di alluminio sull’anodo permise di risolvere il problema, non prima di aver dato fuoco un certo numero di volte al laboratorio dove venivano eseguite le ricerche.
Whittingham annunciò al mondo la sua prima batteria al litio ricaricabile nel 1976. Il risultato era senza precedenti nel settore, ma le batterie riuscivano a immagazzinare ancora quantità ridotte di energia e c’era da risolvere la sfida di ingrandirle per renderle utilizzabili in un’automobile elettrica. All’inizio degli anni Ottanta il prezzo del petrolio scese notevolmente, ed Exxon lasciò perdere i suoi progetti, tornando a concentrarsi sui combustibili fossili.
John Goodenough, un ricercatore del Massachusetts Institute of Technology e poi docente presso l’Università di Oxford nel Regno Unito, riprese il lavoro di Whittingham e pensò che fosse necessario migliorare il catodo della batteria per renderla più efficiente. Sostituendo il materiale di cui era composta portò il potenziale della batteria da 2 a 4 volt, rendendola potente il doppio. Goodenough aveva inoltre capito che la batteria poteva essere prodotta scarica, rendendo più sicuro il processo, e caricata in un secondo tempo.
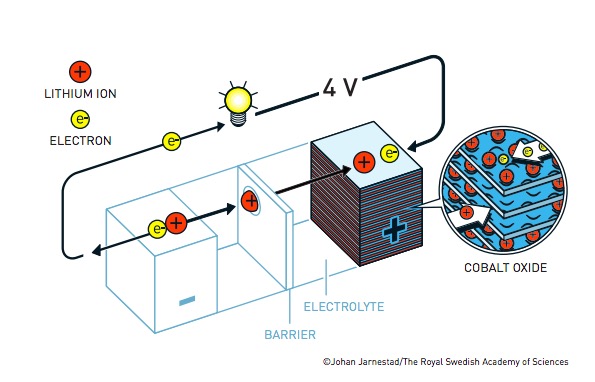
La batteria al litio sviluppata da Goodenough (©Johan Jarnestad/The Royal Swedish Academy of Sciences)
Goodenough dovette però fare i conti con lo stesso problema che aveva incontrato Whittingham: il petrolio in Occidente continuava a costare poco e l’esigenza di produrre batterie più efficienti era poco sentita. Le cose andavano diversamente in Giappone, dove all’epoca si concentravano alcune delle più importanti aziende tecnologiche produttrici soprattutto di fotocamere e videocamere. Avevano bisogno di offrire ai loro clienti prodotti la cui carica durasse più a lungo ed erano quindi molto interessate a batterie di nuova generazione.
Akira Yoshino lavorava per l’azienda chimica giapponese Asahi Kasei e capì che il lavoro di Whittingham e Goodenough fosse un buon punto di partenza per arrivare a una batteria al litio ricaricabile da commercializzare. Pensò che la chiave fosse rivedere il funzionamento dell’anodo, visto che Goodenough era già riuscito a migliorare quello del catodo. Sperimentò diversi materiali e infine trovò che quello ideale fosse il coke petrolifero, un tipo di carbone derivato dalla raffinazione del petrolio. Questa soluzione gli permise di utilizzare solamente gli ioni di litio, producendo una batteria molto più stabile e il cui principio è alla base degli accumulatori che usiamo tutti i giorni.
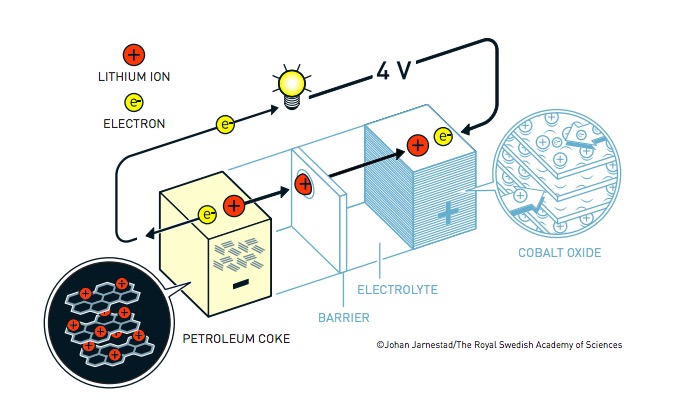
La batteria agli ioni di litio sviluppata da Yoshino (©Johan Jarnestad/The Royal Swedish Academy of Sciences)
Le prime batterie ricaricabili al litio furono messe in vendita nel 1991, rivelandosi efficienti e affidabili. Da allora, chimici e ricercatori studiano altri elementi che potrebbero essere impiegati per superare le attuali batterie, basate sul lavoro di Whittingham, Goodenough e Yoshino. Con le loro scoperte e invenzioni, i tre premi Nobel per la Chimica di quest’anno hanno reso più vicino un futuro meno dipendente dal petrolio e con minori emissioni di anidride carbonica, il principale gas responsabile del riscaldamento globale.



