La tavola periodica ha 150 anni
La gran storia di come Dmitrij Ivanovič Mendeleev pubblicò la prima versione della tabella che spiega tutto ciò che esiste
di Emanuele Menietti – @emenietti
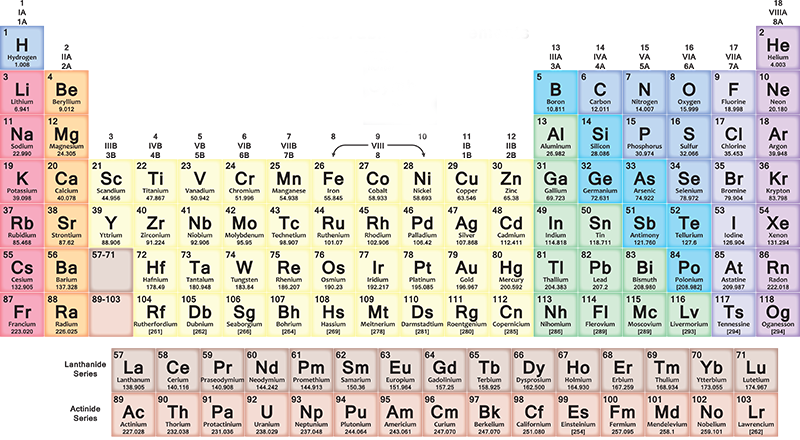
Ogni anno milioni di studenti delle scuole superiori in tutto il mondo si trovano davanti a una tabella variopinta, piena di lettere e numeri, che in un certo senso racconta tutto l’Universo. Questa testimonianza di cosa siamo e di cosa è fatto tutto è la tavola periodica degli elementi, che oggi compie 150 anni. Fu il chimico russo Dmitrij Ivanovič Mendeleev a trovare il modo di ordinare ossigeno, carbonio, ferro e tutti gli altri elementi scoperti – e ancora da scoprire – in una tabella per poterli classificare. La sua intuizione fu resa pubblica per la prima volta il 6 marzo del 1869, ma la storia della tavola periodica era iniziata assai prima e racconta molto di come funziona la ricerca scientifica: il modo in cui cerchiamo di capire il mondo.
La lista di Lavoisier
La maggior parte degli storici della scienza fa risalire le origini della tavola periodica agli studi condotti dal chimico francese Antoine-Laurent de Lavoisier, alla fine del XVIII secolo. Prima di fare una bruttissima fine, condannato a morte per decapitazione dal tribunale rivoluzionario francese, Lavoisier fu l’artefice di alcuni dei progressi più importanti nella ricerca scientifica del suo tempo. Insieme alla moglie Marie-Anne, dedicò molti anni allo studio degli elementi: le sostanze come l’ossigeno e il carbonio che non possono essere “smontate” per reazione chimica in altre sostanze. Lavoisier enunciò inoltre la prima versione della legge di conservazione della massa, dopo avere compreso che in una reazione chimica la somma dei pesi delle sostanze di partenza deve essere uguale a quella delle sostanze che si ottengono dopo la reazione.
Nel 1789 Lavoisier pubblicò una prima lista dei 33 elementi fino all’epoca identificati, sapendo che probabilmente molti altri dovevano essere ancora scoperti (il suo elenco ne mostrava circa un quinto di quelli oggi noti). Oro, ferro e zolfo erano conosciuti fino dall’antichità, mentre altri erano stati scoperti più di recente. Benché incompleta, la lista era il primo tentativo di mettere ordine tra gli elementi, un puzzle molto complicato che avrebbe richiesto più di un secolo per essere risolto e molti altri decenni per essere completato con quasi tutti i suoi pezzi.

(Internet database of periodic tables)
Proust e Dalton
Cinque anni dopo la pubblicazione della sua lista, Lavoisier fu condannato a morte dal tribunale del popolo rivoluzionario e decapitato. Era il 1794, lo stesso anno in cui un altro scienziato, Louis-Joseph Proust, era arrivato alla conclusione che se la legge della conservazione di Lavoisier era valida, allora se ne doveva aggiungere un nuovo pezzo legato alle “proporzioni definite”. Proust enunciò la sua nuova legge nel 1799: quando due o più elementi reagiscono tra loro, formando un composto, si compongono sempre secondo proporzioni in massa definite e costanti.
Nonostante la sua legge suggerisse che i composti chimici dovessero essere fatti di particelle con peso differente, ciascuna riconducibile a un dato elemento, Proust non ci arrivò. Fu lo scienziato britannico John Dalton (al quale dobbiamo il termine “daltonismo”: non vedeva alcuni colori e fu tra i principali studiosi di questa condizione) a dimostrare all’inizio dell’Ottocento che quando due elementi si combinano tra loro per formare composti, una quantità di un elemento si combina con quantità multiple dell’altro, che stanno tra loro come numeri piccoli e interi.
In pratica, se combino 12 grammi di carbonio con 16 grammi di ossigeno ottengo monossido di carbonio (CO), ma se combino i primi con il doppio dell’ossigeno, allora ottengono anidride carbonica (CO2). Con la stessa massa di carbonio, l’anidride carbonica contiene una quantità di ossigeno doppia rispetto a quella del monossido di carbonio. Ne consegue che il valore del rapporto di combinazione è la metà.
Per spiegare la sua legge, Dalton assunse che ogni elemento fosse composto da minuscole cose invisibili all’occhio umano, aventi tutte le stesso peso. Le chiamò “atomi”, riprendendo la parola greca utilizzata per definire qualcosa di indivisibile.
Mettere ordine
In pochi anni Lavoisier, Proust e Dalton avevano formalizzato le tre leggi classiche della chimica (leggi ponderali), dimostrando le potenzialità del metodo scientifico e i rapidi avanzamenti in una disciplina fondamentale per capire come funziona il mondo, ma occorreva fare ordine tra così tante novità.
Tra i primi a farlo ci fu il chimico svedese Jöns Jacob Berzelius, che introdusse le abbreviazioni per gli elementi, utilizzando una o due lettere come “C” per carbonio e “Fe” per il ferro. Alle abbreviazioni aggiunse i numeri, per indicare le proporzioni dei vari elementi: come il “2” in H2O, che indica le due parti di idrogeno legate a una di ossigeno per formare la molecola dell’acqua. Quelle lettere e quei numeri sarebbero finiti nella tavola periodica degli elementi e ancora oggi sono essenziali.
Berzelius era un tipo piuttosto creativo e curioso. Dopo essere venuto a conoscenza della pila elettrica inventata dall’italiano Alessandro Volta, e che produceva elettricità tramite una reazione chimica, iniziò a sperimentare per provare a ottenere l’effetto contrario. Utilizzò l’elettricità proveniente dalla batteria per indurre reazioni chimiche nelle soluzioni, l’elettrolisi.
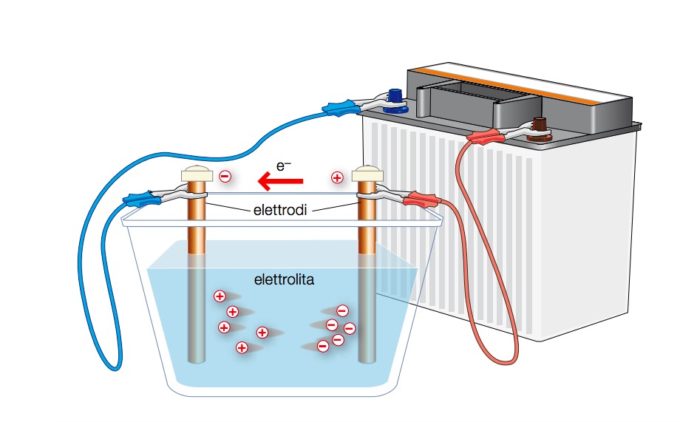
(Zanichelli)
Questa tecnica, ripresa da diversi altri scienziati, si rivelò fondamentale per scoprire un’ampia varietà di elementi chimici, prima ignoti. In pochi anni furono identificati elementi la cui esistenza ora ci sembra da sempre scontata, come il sodio, il magnesio, il potassio e il calcio. Decine di nuovi elementi si aggiunsero alla trentina di quelli elencati da Lavoisier, portando a nuove domande: quanti elementi ci sono davvero in natura? Come possiamo scoprirne altri? Ci sono sostanze che pensiamo essere frutto dell’unione di altri elementi e che invece sono da soli elementi?
La tavola periodica
Mentre proseguiva la corsa agli elementi, diversi scienziati iniziarono a interrogarsi su come ordinare e dare un senso alle nuove scoperte. Per farlo si dovevano esaminare le singole sostanze e confrontarne le caratteristiche alla ricerca di cose in comune. Si scoprì che alcuni elementi potevano essere raggruppati in terzetti e ordinati per peso atomico: l’elemento al centro aveva sempre un peso pari al peso medio tra i suoi due compagni più leggero e più pesante.
Nei primi anni Sessanta dell’Ottocento i chimici avevano a disposizione tre leggi fondamentali, decine di elementi, la conoscenza di qualche caratteristica ricorrente tra loro, ma nessun sistema di catalogazione per orientarsi nel mondo che avevano scoperto. Mettere ordine nella chimica divenne quasi un’ossessione per un professore di chimica presso l’Università di San Pietroburgo in Russia: Dmitrij Ivanovič Mendeleev. Tra fine febbraio e i primi giorni di marzo del 1869, Mendeleev lavorò per dare un senso agli elementi. Fu letteralmente un impegno senza sosta: lavorò giorno e notte, finendo per perdere la cognizione del tempo e arrivando a dire, in seguito, che l’intuizione definitiva per risolvere il puzzle della chimica gli fosse venuta dopo essersi brevemente assopito.

La versione della tavola periodica di Mendeleev pubblicata nel 1869
Mendeleev creò una tavola nella quale gli elementi erano elencati secondo un preciso criterio, che teneva conto delle relazioni tra le loro caratteristiche. Il suo sistema era migliore di altri tentativi fatti in precedenza per un semplice motivo: era più onesto. Contemplava, cioè, la possibilità che vi fossero altri elementi ancora da scoprire e che fosse quindi normale che alcune caselle dello schema fossero vuote. Mendeleev attirò numerose critiche per avere lasciato quei buchi, ma le scoperte dei decenni seguenti gli avrebbero dato ragione.
La tavola non si limitava a contemplare la possibilità che fossero scoperti nuovi elementi: metteva anche in dubbio che alcune delle misurazioni effettuate fino ad allora su alcuni di essi fossero accurate. Nella tabella, Mendeleev invertì alcuni elementi sostenendo questa teoria. In alcuni casi misurazioni più accurate gli diedero ragione, in altri casi no, a dimostrazione che agli scienziati dell’epoca stava sfuggendo ancora qualcosa sul peso atomico.
L’evoluzione della tavola di Mendeleev
La bellezza della tavola periodica degli elementi, probabilmente la griglia più amata dai chimici, è che non si presenta come uno schema uniforme. In alcune righe ci sono una manciata di elementi, mentre altre sono complete con 18 elementi. Si chiama “periodica” perché Mendeleev sfruttò la ricorrenza delle proprietà chimiche, raggruppando gli elementi con caratteristiche chimiche simili.
Con la scoperta di nuovi elementi negli anni seguenti – compresa quella sorprendente per l’epoca dei gas nobili (come l’elio), inerti e quindi difficili da rilevare – la tavola di Mendeleev si rivelò una formidabile base di partenza per affinare uno schema onnicomprensivo degli elementi, nonostante le complicazioni portate da nuove intuizioni ed evidenze scientifiche. Alla fine dell’Ottocento, per esempio, si scoprì che gli atomi potevano perdere dei pezzi, suggerendo quindi che fossero a loro volta formati da parti più piccole e ancora non osservate.
Di nuovo, in pochi decenni la chimica fece enormi passi avanti portando alla formulazione delle teorie sulla struttura atomica. Si scoprirono cose che oggi diamo per scontate come l’esistenza dei protoni (con carica positiva), dei neutroni (privi di carica) e degli elettroni (con carica negativa), cioè i costituenti subatomici. Si arrivò in questo modo alla determinazione del numero atomico, che indica il numero di protoni contenuti in un nucleo atomico.
Non essendo una conoscenza disponibile nel 1869, Mendeleev aveva però ordinato il suo schema sul peso atomico (anche se come abbiamo visto con qualche sostituzione nell’ordine degli elementi per far quadrare l’impianto complessivo). Senza volerlo, Mendeleev aveva ordinato gli elementi in ordine di numero atomico, anni prima che fosse introdotto questo stesso concetto. La sostituzione con i numeri atomici nei valori della tabella portò alla sequenza definitiva che conosciamo oggi della tavola periodica. Oltre alla scoperta della struttura dell’atomo, nel Novecento la meccanica quantistica avrebbe portato a ulteriori evoluzioni e affinamenti della tavola periodica, che sono riflessi nell’attuale modello con 18 colonne.
Com’è fatta e si legge la tavola periodica
Nella tavola periodica, gli elementi sono inseriti progressivamente in ogni riga (periodo) da sinistra a destra secondo la sequenza dei loro numeri atomici: ogni nuova riga inizia dopo un gas nobile. Il primo elemento della riga è sempre un metallo alcalino, con un numero atomico più grande di un’unità rispetto all’elemento con cui si era conclusa la riga precedente. Più in generale, nelle sette righe della tavola, i metalli sono sulla sinistra e gli altri tipi di elementi sulla destra.
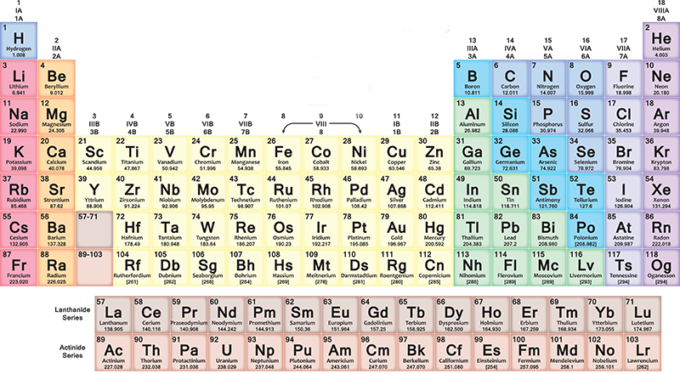
Quindi man mano che ci si sposta verso destra si trovano elementi via via più pesanti, con caratteristiche differenti da metallo a gas. Quando si arriva al fondo di una riga e si inizia quella seguente, sempre da sinistra verso destra, la distribuzione si ripete ciclicamente. Tutto torna con una certa armonia, che vi lascerà sorpresi se proverete a leggere la tavola facendoci attenzione.
Le colonne (gruppi o famiglie) contengono elementi con caratteristiche chimiche simili. Hanno per esempio una stessa configurazione elettronica esterna, cioè elettroni che si comportano allo stesso modo attorno ai nuclei dei loro atomi. Esistono 18 gruppi e si va dal gruppo dei metalli alcalini fino a quello dei gas nobili.
Gli elementi con numero atomico da 1 a 118 occupano le sette righe della tavola periodica: i primi 94 sono tutti naturali, mentre quelli da 95 a 118 sono stati ottenuti artificialmente. Le ricerche per sviluppare nuovi elementi sono ancora in corso, così come ci sono alcuni problemi da risolvere sull’attuale organizzazione dello schema.
Nonostante qualche aggiustamento, nel complesso nei suoi 150 anni di esistenza la tavola periodica degli elementi si è rivelata essenziale non solo per mettere ordine tra gli elementi che formano tutto, compresi gli occhi che state usando per leggere queste parole, ma anche per analizzare le reazioni chimiche, scoprire relazioni tra diversi composti e studiare la fisica nucleare. Le righe e le colonne della tabella sono una sintesi impareggiabile di ciò che è stato della ricerca scientifica che ha permesso di crearla e, in un certo senso, di ciò che sarà.






