I primi dieci anni di CRISPR
Il sistema per modificare pezzi di DNA con estrema precisione ha rivoluzionato la ricerca e ha aperto molte questioni etiche ancora da risolvere
Alla fine di giugno del 2012, sulla rivista scientifica Science fu pubblicata una ricerca che non attirò da subito particolari attenzioni, ma che in seguito si sarebbe rivelata centrale per una delle più grandi rivoluzioni della scienza moderna: la possibilità di modificare velocemente, con precisione e a basso costo il DNA per trattare problemi di salute finora incurabili, creare piante resistenti a un clima sempre più caldo e prevenire le malattie genetiche. Lo studio era soprattutto il frutto del lavoro di due scienziate, Emmanuelle Charpentier e Jennifer A. Doudna, che circa otto anni dopo sarebbero state premiate con il Nobel per la Chimica per CRISPR/Cas9, il loro sistema per modificare pezzi del materiale genetico.
A distanza di dieci anni dalla pubblicazione di quella prima ricerca, CRISPR è diventato una delle più importanti innovazioni della biologia. Viene impiegato quotidianamente in centinaia di laboratori in giro per il mondo per capire quale sia il ruolo di particolari geni, l’unità ereditaria fondamentale degli esseri viventi.
I geni sono costituiti da sequenze di DNA e contengono le istruzioni per produrre specifiche proteine, che portano poi all’espressione di particolari caratteristiche fisiche (tratti) come il colore degli occhi o dei capelli, oppure particolari funzioni delle cellule. Il loro studio è fondamentale per capire che cosa può andare storto nel nostro organismo, causando disfunzioni e malattie. CRISPR rende inoltre possibile la modifica di porzioni del materiale genetico, in modo da attivare o disattivare alcuni geni.
A dirla tutta, Charpentier e Doudna dieci anni fa non inventarono qualcosa di nuovo, ma trovarono il modo di sfruttare un meccanismo presente in alcuni batteri e che era stato notato dai microbiologi a partire dagli anni Ottanta. All’epoca, erano state scoperte alcune porzioni di DNA fatte diversamente da quanto ci si sarebbe aspettati, e per un buon motivo.
Batteri vs virus
Tendiamo a pensare che batteri e virus siano un pericolo per noi e gli altri animali, ma in realtà questi patogeni sono in guerra tra loro praticamente da quando esistono. I batteriofagi (o fagi), per esempio, sono un particolare tipo di virus che va a caccia dei batteri. Lo fanno sistematicamente, tanto che si stima che da soli causino giornalmente la morte del 40 per cento circa dei miliardi di miliardi di batteri che vivono a mollo negli oceani. La lotta è strenua e i batteri riescono a non estinguersi grazie alla rapidità con cui si moltiplicano, formando miliardi di nuovi esemplari ogni giorno e utilizzando alcune particolari difese.
Quando i fagi entrano in contatto con i batteri, iniettano al loro interno il proprio materiale genetico, trasformando i batteri in piccole fabbriche che produrranno nuove copie dei virus che a loro volta infetteranno altri batteri. È il principio base di funzionamento di numerosi virus, come abbiamo ormai imparato in oltre due anni di pandemia. A differenze del nostro organismo, i batteri hanno sistemi di difesa meno elaborati e spesso falliscono nel resistere all’invasore virale.
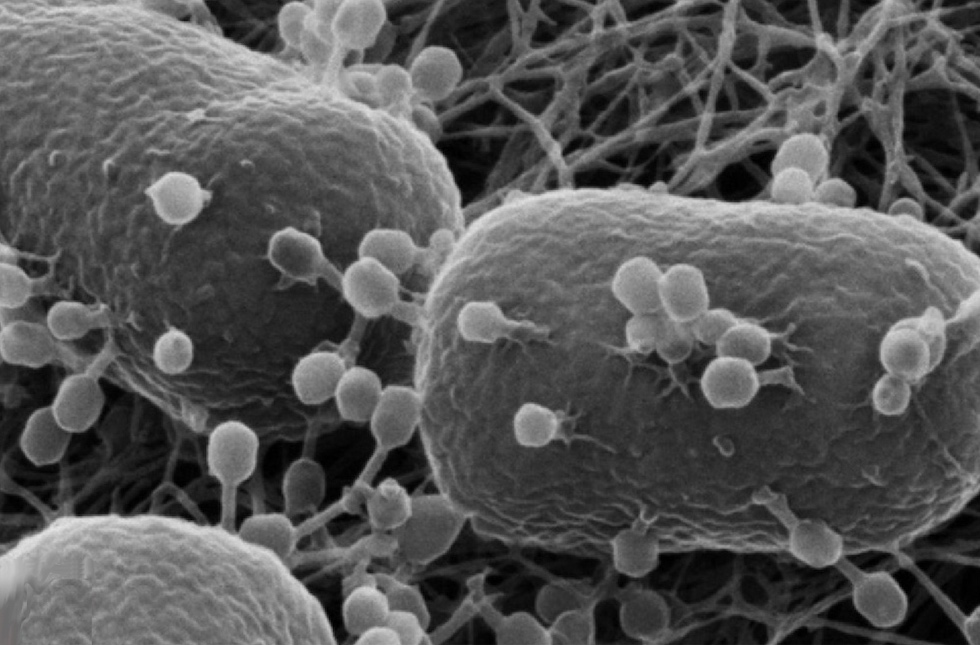
Batteriofagi all’attacco di alcuni batteri di E. coli, le strutture più grandi (Wikimedia)
Ci possono però essere alcune circostanze in cui i batteri riescono a respingere l’attacco da parte dei batteriofagi, con una soluzione semplice e al tempo stesso raffinata. I batteri trasferiscono parte del materiale genetico del virus nel loro codice genetico, creando una sorta di catalogo che viene appunto chiamato CRISPR, da clustered regularly interspaced short palindromic repeats (brevi ripetizioni palindrome raggruppate e separate a intervalli regolati).
Se il batterio entra nuovamente in contatto con un virus, produce una copia del materiale genetico che aveva archiviato e la passa a una proteina che si chiama Cas9. Lavorando come un’archivista, questa si mette al lavoro e cerca nel batterio pezzi di DNA e li confronta con quelli in archivio, per capire se stia avvenendo un attacco da parte di un virus. Nel caso in cui rilevi una corrispondenza, taglia la sequenza genetica appartenente al virus, rendendola in questo modo innocua. Non essendoci più istruzioni complete, il batterio non può diventare la fabbrica di nuovi virus e non rischia di fare una brutta fine.
CRISPR/Cas9
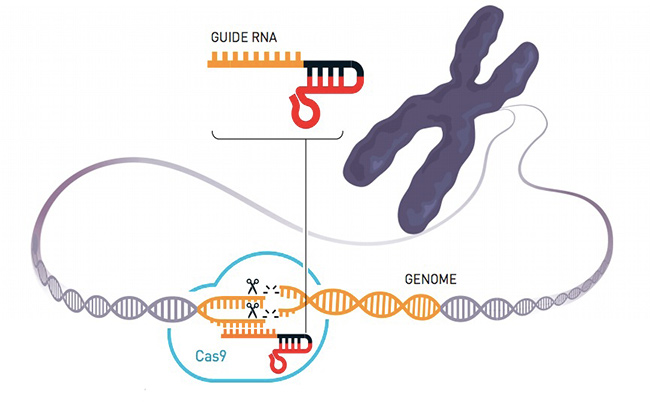
Cas9 è una proteina molto accurata nel tagliare pezzi di DNA, come ebbero modo di sperimentare Charpentier e Doudna nei loro laboratori e analizzando le ricerche svolte in precedenza. Si chiesero quindi se potessero sfruttare Cas9 per trasformarla in una specie di sarta del materiale genetico, per modificarlo tagliandone e copiandone pezzi, cucendoli se necessario altro lungo la doppia elica del DNA. Riuscirci non fu semplice, ma quando infine nel 2012 realizzarono il primo sistema di “forbici genetiche”, quelle descritte nel loro studio, capirono di avere realizzato qualcosa dalle enormi potenzialità e che avrebbe poi portato allo sviluppo di altre soluzioni simili (noi ci concentreremo soprattutto su Cas9).
Le forbici di CRISPR/Cas9 partono da una sequenza genetica (RNA guida) preparata in laboratorio che corrisponde a quella del DNA dove si deve effettuare il taglio nella cellula. La proteina Cas9 si attiva e realizza il taglio: in mancanza di altre istruzioni, la cellula ripara il proprio DNA perdendo un pezzo del codice genetico, in molti casi rendendo inutilizzabile proprio il gene che il gruppo di ricerca voleva disattivare. Questo sistema permette inoltre di inserire del nuovo DNA nella fase di riparazione, nel caso in cui si voglia invece modificare il funzionamento della cellula.
Malattie genetiche e piante
CRISPR ha rivoluzionato il modo di fare editing perché in precedenza modificare i geni era estremamente difficile, richiedeva molto tempo e spesso portava a risultati poco affidabili. In dieci anni il nuovo sistema si è mostrato affidabile, per quanto ancora perfettibile, ed è diventato diffuso in numerosi ambiti della ricerca e con prime applicazioni pratiche in ambito sanitario.
Uno degli ambiti più promettenti per CRISPR si è dimostrato essere lo sviluppo di nuove terapie contro le malattie ereditarie. Alcune settimane fa, per esempio, sono stati presentati i primi risultati di un test clinico condotto su 75 volontari affetti da anemia mediterranea o da anemia falciforme, due malattie ereditarie del sangue che riducono la capacità del sangue di trasportare ossigeno tramite l’emoglobina.
Gli autori dello studio hanno sfruttato il fatto che gli esseri umani possiedono diversi geni che regolano l’emoglobina. Uno di questi è legato all’emoglobina fetale, che come suggerisce il nome è attiva solamente nei feti e si disattiva poi a qualche mese dalla nascita. Dal midollo osseo dei volontari sono state quindi prelevate cellule non ancora specializzate, poi con CRISPR è stato escluso il gene responsabile della disattivazione del meccanismo dell’emoglobina fetale. Le cellule modificate sono state poi trasfuse nuovamente nei volontari, che hanno così iniziato a produrre l’emoglobina necessaria al sangue per trasportare l’ossigeno.
Su 44 volontari con anemia mediterranea, dopo il trattamento 42 non hanno più avuto bisogno di sottoporsi periodicamente alle trasfusioni di sangue, come devono fare solitamente le persone con questa malattia. I risultati sono stati promettenti anche per i malati di anemia falciforme e per questo le due aziende coinvolte nello sviluppo del sistema, CRISPR Therapeutics e Vertex chiederanno presto alle autorità sanitarie statunitensi un’autorizzazione per il loro trattamento.
CRISPR Therapeutics è stata cofondata da Charpentier e ha vari progetti di ricerca in corso. Anche Doudna ha cofondato una propria azienda, Caribou Biosciences, impiegata in altre sperimentazioni nel settore sempre basate sull’editing con CRISPR.
Altre importanti aree di sperimentazione e applicazione sono legate alla ricerca contro il cancro. Già nei primi anni dopo la pubblicazione dello studio, numerosi gruppi di ricerca avevano iniziato a utilizzare CRISPR per capire meglio il ruolo di alcuni geni e disattivarli, osservandone le conseguenze in laboratorio. In questo modo è stato per esempio possibile scoprire un gene con un ruolo centrale nella crescita di alcuni tipi di tumore, portando poi allo sviluppo di un farmaco per inibire la sua attività in modo da fermare la diffusione delle cellule cancerose nell’organismo.
In altri ambiti, per esempio quello agricolo, CRISPR può essere utilizzato per produrre piante più resistenti e per migliorare la resa dei raccolti. In questi anni sono state per esempio sperimentate soluzioni per rendere la soia e i cereali più resistenti alla siccità, facendo in modo che abbiano bisogno di meno acqua per crescere.

Sperimentazioni sulle piante utilizzando CRISPR/Cas9, presso l’Istituto Leibniz per la genetica delle piante e la ricerca sulle piantagioni a Gatersleben, Germania (Sean Gallup/Getty Images)
Altre sperimentazioni hanno riguardato soluzioni per rendere le piante più resistenti ai parassiti o ancora in grado di crescere in condizioni ambientali non ottimali, in modo da dover ricorrere con minore frequenza agli antiparassitari e ai fertilizzanti. Piante di questo tipo non solo potrebbero contribuire a ridurre i rischi che si verifichino crisi alimentari, a livello locale o globale come quella degli ultimi mesi, ma anche di migliorare la resa dei campi in termini energetici, dovendo produrre meno prodotti chimici per favorire la crescita nei campi.
Etica, costi e opportunità
Risultati simili erano già stati ottenuti prima dell’introduzione di CRISPR, ma con tecniche più costose e minori opportunità per i centri di ricerca più piccoli di condurre sperimentazioni rilevanti. Come era già emerso all’epoca, la possibilità di creare piante geneticamente modificate porta con sé numerose complicazioni, legate sia alla percezione della loro sicurezza da parte della popolazione, sia per le opportunità commerciali che spingono le grandi multinazionali a brevettare le loro sementi OGM, rendendole talvolta meno accessibili, soprattutto per i paesi più poveri.
L’impiego di CRISPR, come di altre tecniche di editing del genoma, pone poi vari temi etici, considerate le ampie possibilità nell’alterazione degli embrioni umani. Se ne discusse molto nel 2018, quando il ricercatore cinese He Jiankui, annunciò la nascita di una coppia di gemelle modificate geneticamente, cui si aggiunse un altro bambino pochi mesi dopo. He aveva modificato un embrione umano con l’obiettivo di ottenere una resistenza all’HIV, il virus che può portare all’AIDS.
La notizia fu ampiamente commentata e criticata nella comunità scientifica, e non solo, per le numerose implicazioni che avrebbe potuto avere e per la salute dei neonati coinvolti. Nel 2019 un tribunale cinese condannò a tre anni di carcere He per pratiche mediche illecite, mentre non si sono più avute notizie chiare sullo stato di salute dei tre bambini.
He rimane a oggi l’unico caso noto di un ricercatore che si sia spinto così avanti, ma CRISPR pone molte domande sulle potenzialità per intervenire sugli embrioni e modificarne il corredo genetico. A fini terapeutici è una grandissima opportunità, ma potrebbe avere altri esiti difficili da governare. Ci si chiede per esempio fino a dove si potrebbero un giorno spingere i futuri genitori di un bambino nel richiedere modifiche: un conto sarebbe escludere il rischio di una malattia genetica invalidante, un altro scegliere altri tratti come il colore degli occhi o dei capelli.
Con le tecniche attualmente disponibili, siamo ancora lontani da questa eventualità, ma i progressi degli ultimi anni non fanno escludere che un giorno nemmeno troppo lontano le possibilità di avere ampia scelta sulle modifiche per gli embrioni. È un problema su cui si stanno interrogando esperti, comitati etici e i governi, con un confronto estremamente delicato i cui esiti condizioneranno buona parte della ricerca medica, e più in generale delle discipline biologiche, dei prossimi decenni.
Un approccio eccessivamente rigido potrebbe far perdere importanti opportunità per migliorare la salute di milioni di persone, bloccando importanti progressi nel settore, sostiene chi è più restio a introdurre nuove leggi e regolamenti. Al contrario, chi vorrebbe regolamentare più rigidamente l’editing del genoma sostiene che sia l’unico modo per evitare storture o il rischio che alcune soluzioni siano accessibili solo ai più ricchi, che potrebbero permettersi pratiche mediche brevettate e molto costose.
La modifica degli embrioni a livello del DNA continua comunque a essere un’attività difficile: CRISPR ha reso più accessibili alcune tecniche per farlo, ma sono emersi altri ostacoli legati a come si riorganizza il materiale genetico nelle cellule nel caso di particolari modifiche. Il sistema esiste del resto da appena dieci anni ed è considerato un importante punto di partenza, verso una meta ancora distante, ma che appare meno irraggiungibile di un tempo.